Исследования и фундаментальные достижения последних десятилетий в микробиологии, генетике и молекулярной биологии дали возможность изучения генетического разнообразия бактериальных штаммов. С развитием генетической систематики, с расширением круга используемых методов, направленных на изучение бактериального генома, и накоплением экспериментальных данных, касающихся генетического разнообразия различных таксономических групп бактерий, современная таксономия бактерий стала быстро развиваться, что позволило решить многие спорные вопросы систематики конкретных групп микроорганизмов [1]. Вместе с тем оставались нерешенными проблемы, связанные с противоречиями между данными молекулярной систематики и традиционными представлениями, основанными на анализе фенотипа в отношении группы молочнокислых бактерий, имеющих практическое применение. Многими исследователями отмечалось, что у микробиологов возникают трудности при идентификации на видовом и дифференциации на внутривидовом уровне бактерий различных родов факультативных анаэробов. Особенно трудно идентифицировать виды внутри родов: Lactococcus, Pediococcus, Streptococcus, Lactobacillus с помощью классических фенотипических методов [2–4].
Идентификация молочнокислых бактерий по морфологии, физиологическим потребностям и биохимическому тесту недостаточно эффективны, так как многие бактериальные популяции имеют сходную потребность к питательным субстратам и растут в сходных условиях среды [5]. Альтернативным подходом является анализ последовательности ДНК [6–7]. Данный метод идентификации можно применять как к грамположительным, так и к грамотрицательным бактериям [8]. В качестве генетического маркера для идентификации молочнокислых бактерий широко используется ген 16S rRNA [9–10]. В настоящее время используется полифазный подход, который заключается в объединении всех возможных данных, как фенотипического, так и генетического характера, с целью получения достоверной идентификации [11]. Данное исследование направлено на применение полифазного подхода для идентификации молочнокислых бактерий.
Материалы и методы исследования
В работе были использованы 3 штамма бактерий рода Lactobacillus, зарегистрированные в коллекции промышленных микроорганизмов РГП «Институте микробиологии и вирусологии» КН МОН РК, по паспортным данным принадлежащие к Lactobacillus curvatus 18д, Lactobacillus acidophilus 27W, Lactobacillus fermentium 27 и 15 нуклеотидных последовательностей генов 16S rRNA молочнокислых бактерий, депонированные в базе данных NCBI.
Определение и анализ нуклеотидных последовательностей генов 16SrRNA. Геномную ДНК выделяли методом Kate Wilson [12]. Концентрацию ДНК измеряли спектрофотометрическим методом с использованием спектрофотометра Nano Drop 1000 при длине волны 260 нм, а также проводили качественную оценку ДНК электрофоретическим методом. Матрицы для секвенирования синтезировали с помощью ПЦР, используя универсальные праймеры 8f-5’–AgAgTTTgATCCTggCTCAg-3 и 806R-5’- ggACTACCAgggTATCTAAT-3 [13], что позволяло амплифицировать ген 16S rRNA почти полностью. Реакционная смесь (30 мкл) содержала 3 мкл 10х реакционного буфера (Fermentas), 2,5 мM MgCl2 , 0,2 мM каждого дезоксирибонуклеозидтрифосфата (дНТФ), по 10 пмоль каждого из праймеров, 1 единицу Taq –полимеразы Maxima Hot Start Taq DNA Polymerase (Fermentas, США) и 150 нг геномной ДНК в качестве матрицы. ПЦР проводили в термоциклере Mastercycler pro S (Eppendorf). Реакцию начинали инкубированием смеси при 95 °С в течение 7 минут, затем следовало 30 циклов, состоящих из инкубаций: 95 °С – 30 секунд, 55 °С – 40 секунд, 72 °С – 1 мин. Завершающую элонгацию проводили при 72 °С в течение 10 минут. Продукты амплификации разделяли в 1,5 % агарозном геле. Гели окрашивали этидиум бромидом. Электрофорез проводили в камере для горизонтального электрофореза Bio-RAD Basic, и источником тока «Consort EV-243». В качестве электродного буфера использовали 1хТАЕ-буфер. Документирование полученных результатов проводили, используя систему документаций гелей Gel Doc. Размеры молекул анализируемых образцов ДНК определяли путем сопоставления их электрофоретической подвижности маркеров – фрагмент ДНК известной молекулярной массы. В качестве маркера молекулярных масс использовали O’GeneRuler™ 100bp Plus DNA Ladder производства (Fermentas). ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфолирирования с помощью щелочной фосфатазы (SAP-shimp alkaline phosphatase) и эндонуклеазы I [14]. Секвенирование фрагментов гена 16S rRNA идентифицируемых бактерий проводили на автоматическом секвенаторе 3730хl DNA Analyzer (Applide Biosystems, США) с использованием набора Big Dye Terminator v3.1 Cycle Sequencing Kit (Applide Biosystems, США), придерживаясь рекомендаций производителя. Результаты секвенирования обрабатывали в программе SeqMan (Applide Biosystems). Поиск гомологичных нуклеотидных последовательностей генов 16S rRNA осуществляли с помощью программы BLAST в базе данных Gene Bank Национального центра биотехнологической информации США. Идентификация была осуществлена относительно инвентарных номеров Genе Bank первых трех нуклеотидных последовательностей, имеющих максимальное совпадение. Филогенетический анализ проводили с использованием программного обеспечения MEGA4 [15]. Выравнивание нуклеотидных последовательностей проводили, используя алгоритм ClustalW [16]. Для построения филогенетических деревьев использовали метод «объединения соседей» Neiighbor-Joining (NJ) [17].
Результаты исследования и их обсуждение
Филогенетический анализ нуклеотидных последовательностей генов 16S rRNA у рода Lactobacillus. В нашем исследовании генетическая идентификация 3-х штаммов была осуществлена методом определения прямой нуклеотидной последовательности фрагмента 16S rRNA гена, с последующим сравнением нуклеотидной идентичности с последовательностями, депонированными в международной базе данных Gene Bank, а также построением филогенетических деревьев с нуклеотидными последовательностями референтных штаммов.
В результате выделения ДНК были получены образцы с высокой концентрацией ДНК от 80 до 150 нг/мкл, соотношение длин волн 260/280 в среднем составило 1,99. Методом ПЦР был амплифицирован фрагмент 16S rRNA гена, молекулярной массой размером около 800 п.н. Результаты амплификации образцов с отрицательным контролем отображены на рис. 1.
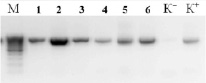
Рис. 1. Электрофорерограмма ПЦР продуктов амплификации фрагмента 16S rRNA гена ДНК: 1) – №27w, 2) – №27, 3) – №18g; (М) – маркер молекулярной массы O’GeneRuler™ 100bp Plus DNA (Fermentas) (100–1000 п.н. от 100–1000 шаг 100 п.н.), (К-) – отрицательный контрольный образец; (К+) – положительный контрольный образец
Продукты ПЦР амплификации были использованы для определения нуклеотидной последовательности. Для исключения методической погрешности анализа 16S rRNA гена дополнительно было проведено построение филогенетических деревьев (рис. 2, 3–4). После удаления последовательности праймеров в неперекрывающихся областях были получены нуклеотидные последовательности размером 650 п.н. При выравнивании было выявлено, что нуклеотидные последовательности фрагмента 16S rRNA гена референтных штаммов
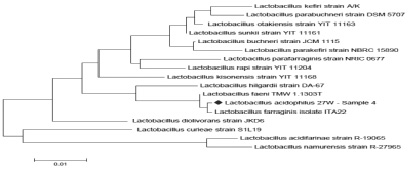
Рис. 2. Филогенетическое дерево, основанное на анализе структур фрагментов гена 16S rRNA, отражающее родственные связи штаммов молочнокислых бактерий рода Lactobacillus
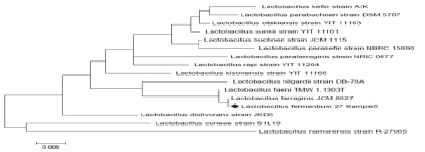
Рис. 3. Филогенетическое дерево, основанное на анализе структур фрагментов гена 16S rRNA, отражающее родственные связи штаммов молочнокислых бактерий рода Lactobacillus
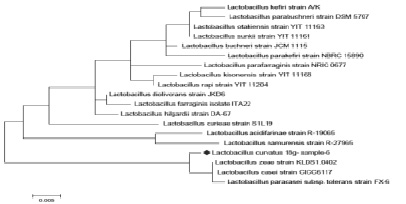
Рис. 4. Филогенетическое дерево, основанное на анализе структур фрагментов гена 16S rRNA, отражающее родственные связи штаммов молочнокислых бактерий рода Lactobacillus
Lactobacillus farraginis (KF297813.1), Lactobacillus faeni (AM266587.1), Lactobacillus hilgardii (KJ128233.1) и Lactobacillus farraginis (AB690214.1), Lactobacillus faeni (AM266587.1) и Lactobacillus hilgardii (KJ128234.1), а также Lactobacillus paracasei (KF544958.1), Lactobacillus casei (KJ833598.1) и Lactobacillus zeae (KF977412.1) имели размер 560 и 550 п.н., соответственно. В связи с этим, для формирования однородной выборки размером 550 п.н. была удалена часть нуклеотидных последовательностей у исследуемых штаммов. Процент идентичности фрагментов нуклеотидных последовательностей 16S rRNA гена между Lactobacillus curvatus №18g c референтными штаммами Lactobacillus paracasei, Lactobacillus casei и Lactobacillus zeae составил – 99 %. У штаммов Lactobacillus acidophilus № 27W и Lactobacillus fermentium № 27 с референтными штаммами Lactobacillus farraginis и Lactobacillus faeni составил – 100–99 %, а также Lactobacillus hilgardii составил – 97 %.
Результаты филогенетического анализа последовательностей гена 16S rRNA у изучаемых штаммов представлены на филогенетическом дереве (рис. 2, 3–4), построенном в программе MEGA4, с использованием Neiighbor-Joining кластерного метода расчета генетических расстояний и bootstrap анализа, отражающего достоверность кластеризации.
Как видно из представленных данных, по характеру последовательностей штаммы можно распределить в 2 кластера, один из которых составляет культуру Lactobacillus farraginis, нуклеотидные последовательности которых характеризуются 100 % сходством. Второй кластер включает штамм Lactobacillus faeni сходство последовательностей гена 16S rRNA у которого составило – 99 % (рис. 2). Как видно из рис. 2, нуклеотидные последовательности штамма идентифицируемого как Lactobacillus acidophilus №27W, при идентификации в Genе Bank находятся на одной филогенетической ветви с Lactobacillus farraginis. Таким образом, штамм Lactobacillus acidophilus №27W на основании анализа нуклеотидной последовательности гена 16S rRNA идентифицирован как Lactobacillus farraginis. В основном кластере бактерий Lactobacillus farraginis, характеризовался более высоким уровнем вариабельности генов 16S rRNA, чем кластер, образуемый Lactobacillus faeni. Штамм Lactobacillus acidophilus №27W был тесно связан с референтным штаммом Lactobacillus farraginis, что позволяет рассматривать его как филогенетически наиболее близкий к типовому штамму вида Lactobacillus farraginis. Это является обоснованием для правомерности его отнесения к Lactobacillus farraginis (KF297813.1) (рис. 2).
Из представленных данных, по характеру последовательностей штаммы можно распределить в 2 кластера, один из которых составляет культуру Lactobacillus farraginis, нуклеотидные последовательности которых характеризуются 100 % сходством. Второй кластер включает штамм Lactobacillus faeni сходство последовательностей гена 16S rRNA у которого составило – 99 % (рис. 3). Как видно из рис. 3, нуклеотидные последовательности штамма идентифицируемого как Lactobacillus fermentium №27 при идентификации в Genе Bank находятся на одной филогенетической ветви с Lactobacillus farraginis. Таким образом, штамм Lactobacillus fermentium № 27 на основании анализа нуклеотидной последовательности гена 16S rRNA идентифицирован как Lactobacillus farraginis. В основном кластере бактерий Lactobacillus farraginis, характеризовался более высоким уровнем вариабельности генов 16S rRNA, чем кластер, образуемый Lactobacillus faeni. Штамм Lactobacillus fermentium № 27 был тесно связан с референтным штаммом Lactobacillus farraginis, что позволяет рассматривать его как филогенетически наиболее близкий к типовому штамму вида Lactobacillus farraginis. Это является обоснованием для правомерности его отнесения к Lactobacillus farraginis (AB690214.1) (рис. 3).
Как видно на рис. 4, при филогенетическом анализе фрагмента 16S rRNA гена штамм Lactobacillus curvatus №18g был объединен в один кластер с Lactobacillus paracasei. При идентификации в Genе Bank штамм Lactobacillus curvatus №18g находится на одной филогенетической ветви образуемой бактериями Lactobacillus paracasei KF544958.1, Lactobacillus casei (KJ833598.1) и Lactobacillus zeae (KF977412.1) что указывало на его принадлежность к одному из этих видов и исключало возможность отнесения к Lactobacillus curvatus. Разграничение видов Lactobacillus paracasei, Lactobacillus casei и Lactobacillus zeae на основании результатов проведенного филогенетического анализа оказалось невозможным. Причиной этого можно считать низкую вариабельность нуклеотидных последовательностей генов 16S rRNA.
Коллекционные штаммы лактобацилл по результатам нашего анализа последовательностей их генов 16S rRNA были разделены на 2 группы. В первую группу Lactobacillus buchneri вошел штамм Lactobacillus acidophilus №27W и Lactobacillus fermentium № 27, видовая принадлежность которого не соответствует их исходным паспортным данным, составленным на основании традиционных микробиологических методов исследования. Ко второй группе Lactobacillus casei-paracasei отнесен штамм Lactobacillus curvatus № 18g, у которого последовательность гена 16S rRNA также не соответствует видовому положению, указанному в паспортных данных. Сравнение нуклеотидных последовательностей генов 16SrRNA коллекционных штаммов с таковой международных баз данных позволили установить, что штаммы № 27w, № 27 и № 18g идентифицированные ранее, как штаммы Lactobacillus acidophilus № 27W, Lactobacillus fermentium № 27 и Lactobacillus curvatus № 18g на самом деле относятся к Lactobacillus farraginis – к группе Lactobacillus buchneri, а штаммы Lactobacillus paracasei Lactobacillus casei и Lactobacillus zeae – к группе Lactobacillus casei/paracasei.
Секвенирование гена 16S rRNA выявило высокий уровень гомологии с представителями рода Lactobacillus: штамм Lactobacillus acidophilus №2 7W – 100 % с Lactobacillus farraginis (KF297813.1); а штамм Lactobacillus curvatus № 18g – 100 % с Lactobacillus paracasei KF544958.1, Lactobacillus casei (KJ833598.1) и Lactobacillus zeae (KF977412.1). А также штамм Lactobacillus fermentium № 27 – 100 Lactobacillus farraginis (AB690214.1).
Следовательно, сравнительный анализ нуклеотидных последовательностей трех штаммов молочнокислых бактерий показал их высокую идентичность с референтным штаммом.

