Новым направлением в хирургии и ожоговой практике является вульнеросорбция, позволяющая удалять экссудат, микроорганизмы и их токсины из раны при помощи сорбционных материалов. Для заживления ожоговых и гнойных ран перспективна разработка адсорбентов, способных не только удалять экссудат и жидкость, но и дополнительно воздействовать на процессы воспаления и регенерации в ране. В этом плане большой интерес представляют собой наружные лекарственные средства (ЛС) в виде порошков, способные воздействовать на рану за счет улучшения микроциркуляции крови в зоне поражения.
Одним из перспективных вазодилатирующих ЛС является монооксид азота (в виде газа) или ЛС, способные образовывать нитрозильные комплексы, генерирующих монооксид азота. В настоящее время доказано, что монооксид азота не только улучшает микроциркуляцию крови, влияет на агрегацию тромбоцитов, но и играет важную роль в течение раневого процесса [1, 2].
Известно, что нитрозильные комплексы железа с серосодержащими лигандами являются депо монооксида азота [3–5]. Наиболее изучены в этом плане нитрозильные комплексы цитохрома с, имеющего железосодержащий порфириновый гем. Дизайн новых нитрозильных комплексов цитохрома с открывает возможности в создании ЛС с заданными биологическими свойствами для разработки современных стратегий в лечении раневых процессов.
Ранее нами было показано, что взаимодействие цитохрома с и нитросодержащих препаратов, таких как нитрит натрия, метронидазол, 5-нитрофурал, 5-нитроксолин, приводит к образованию нитрозильных комплексов цитохрома с, аналогичных нитрозильным комплексам, образованным цитохромом с и газообразным монооксидом азота [6]. На основании этих исследований была предложена комбинированная лекарственная форма «водный гель полисахарида + порошок (нитропрепарат, цитохром с», демонстрирующая в эксперименте на крысах высокие регенеративные и репаративные свойства и вазодилатирующий эффект [7].
В настоящей работе нами исследовано новое ЛС в виде порошка с цитохромом с, в котором в качестве донатора нитроксидной группы был выбран 5-нитрофурал из группы нитрофуранов, эффективных в отношении грамположительных и грамотрицательных бактерий. Роль стабилизатора и активатора восстановленной формы цитохрома с выполнял натрия аскорбат, дополнительным кератолитиком и антисептиком выступал цинк оксид, а в качестве основного сорбента был использован крахмал картофельный.
Целью работы является разработка методов качественного и количественного определения действующих веществ противоожогового порошка, содержащего цитохром с и 5-нитрофурал, как депо монооксида азота на ране, и валидационная оценка методов количественного определения по показателям правильность, воспроизводимость, линейность и сходимость действующих веществ.
Материалы и методы исследования
Реактивы: цитохром с (из сердца лошади) (≥ 95 %, lot STBB7839V, «Fluka» (USA) «Sigma-Aldrich»), нитрофурал (≥ 97 %, Product Number: 59870, «Aldrich» (USA) «Sigma-Aldrich»), натрия аскорбат (≥ 99 %, lot BCBJ1585V, «Fluka» (USA) «Sigma-Aldrich»), оксид цинка (ГОСТ 10262-73), крахмал (≥ 95 %, Product Number: 9005-25-8, «Fluka» (USA) «Sigma-Aldrich»), гидроксид натрия (ГОСТ 4328-77), кислота азотная («ХЧ», ГОСТ 4461-77), ацетонитрил для хроматографии сорт 0 (ТУ 2636-040-44493179-00), вода очищенная, полученная на установке «Elix-3» фирмы «MILLIPORE», удельное сопротивление менее 0,2 µСм.
Анализ электронных спектров был выполнен на UV-vis спектрофотометре Specord S100 Bioline (Analytic Jena, Германия), толщина кварцевой кюветы 10 мм.
ВЭЖХ-анализ 5-нитрофурала и натрия аскорбата проводили на высокоэффективном жидкостном хроматографе марки Shimadzu LC-10 Avp в обращенно-фазовом режиме, колонка Discovery C18 (250×4,6 mm, 5 μm) с диодно-матричным УФ-детектором. Условия хроматографирования: подвижная фаза ацетонитрил—фосфатный буфер 27:73 (ν/ν) в изократическом режиме при скорости потока 1 мл/мин при температуре 35 °C, объем инжекции 20 μL, детектирование при длинах волн 310 и 254 нм, время анализа 10 мин.
Элементный анализ выполняли на атомно-абсорбционном спектрофотометре (ААС) Shimadzu AA 7000. А). Количественное определение железа в цитохроме с проводили с использованием стандартных растворов Fe(NO3)3, лампы полого катода с λ = 248,33 нм, в газовой среде – аргон. Объем пробы – 20 μL. Б). Количественное определение цинка в оксиде цинка проводили непрерывно-пламенным методом, используя стандартные растворы Zn, лампу с полым катодом при λ = 213,9 нм в газовой среде воздух – ацетилен, 2,2 л∙мин-1. Объем пробы – 20 μL.
Стандартные растворы железа с концентрацией 2; 6; 10 мкг/л готовили из ГСО 7872-2000 Fe (10 мг/см3,фон – 1 М HNO3).
Стандартные растворы цинка с концентрацией 0,1; 0,2; 0,4 мг/л готовили из ГСО 7837-2000 Zn (10 мг/см3,фон – 1 М HNO3).
Приготовление модельных смесей 1,2,3: 0,25 г; 0,5 г; 0,75 г (точная навеска) 5-нитрофурала помещают в ступку, перетирают, добавляют 0,05 г цитохрома с, 0,1 г натрия аскорбата, 0,1 г цинка оксида до 100 г крахмала. Смесь перетирают пестиком до однородной желтоватой массы. 0,5 г (точная навеска) полученного порошка переносят в стакан на 50 мл, добавляют 15 мл подвижной фазы ацетонитрил-фосфатный буфер pH 6 в соотношении 27:73 (ν/ν), растворяют, фильтруют через фильтр «синяя лента» в мерную колбу вместимостью 25 мл. Раствор в мерной колбе доводят до метки раствором подвижной фазы (соответствует 50 %, 100 %, 150 % ожидаемой концентрации испытуемого раствора).
Приготовление модельных смесей 4,5,6 выполняют аналогично процедуре приготовления модельных смесей 1,2,3, используя 0,05 г; 0,1 г; 0,15 г (точной навески) натрия аскорбата. Состав смеси: 0,05 г цитохрома с, 0,5 г нитрофурала, 0,1 г цинка оксида и натрия аскорбата, крахмала до 100 г. После растворения порошка в 25 мл раствора подвижной фазы, концентрация натрия аскорбата в испытуемом растворе соответствовала 50 %, 100 %, 150 % от ожидаемой.
Стандартные растворы натрия аскорбата (0,02 мг/мл), 5-нитрофурала (0,1 мг/мл) готовили из стандартных образцов субстанций.
Статистическую обработку проводили по программе Statistica 7.0 (р < 0,05).
Результаты исследования и их обсуждение
Общая схема пробоподготовки для анализа всех действующих веществ представлена ниже:
Методика качественного и количественного определения 5-нитрофурала и натрия аскорбата в порошке.
Идентификацию 5-нитрофурала проводили, используя визуальный тест (переход из желтой в оранжевый цвет аци-соли после добавления 30 % гидроксида натрия) и УФ – спектроскопически, анализируя полученный водно-ацетонитрильный раствор (λ = 375 нм) и, сопоставляя этот спектр со спектром аци-соли (появление плеча λ = 450 нм) (рис. 2).
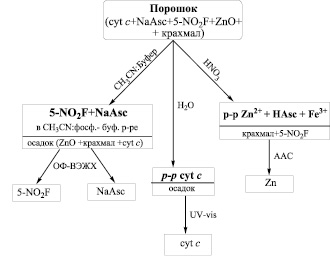
Рис. 1. Общая схема пробоподготовки для анализа действующих веществ порошка
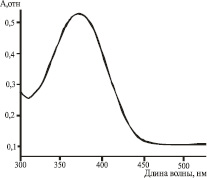
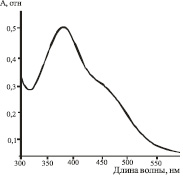
а) б)
Рис. 2. УФ-спектры ацетонитрильно-буферного раствора смеси 5-нитрофурала и натрия аскорбата после растворения порошка и удаления осадка: 2 а) исходный раствор; 2 б) после добавления 30 % гидроксида натрия
Натрия аскорбат доказывали тестом с аммиачным раствором серебра по образованию черного осадка серебра.
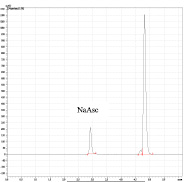
Два компонента 5-нирофурал и натрия аскорбат анализировали ОФ ВЭЖХ методом после растворения порошка в смеси ацетонитрил:фосфатный буферный раствор pH 6 при объемном соотношении 27:73 и удаления нерастворимого осадка, содержащего цитохром с, оксид цинка и крахмал (рис. 1).
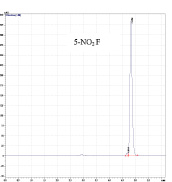
Время выхода пика 5-нитрофурала – 4,8 мин, натрия аскорбата – 2,9 мин на хроматограммах растворов модельных смесей совпадало со временем выхода этих соединений в стандартных растворов в изократическом режиме при t = 35 °C (рис. 3).
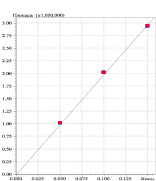
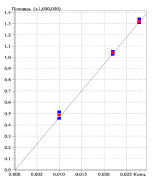
Определение линейности проводили на 3 уровнях концентраций для 5-NO2 F и для NaAsc от ожидаемых содержаний в порошке. Уравнения линейной регрессии имеют вид: у = 1.980504e + 007 (5-NO2 F) и у = 4.720793e + 007 (NaAsc). Значения коэффициента корреляции для обоих веществ было равным 0,99, что соответствует критерию приемлемости по показателю линейности [8].
|
а) |
б) |
Y = aX + b a = 1.980504e+007 b = 0.0 R2 = 0.9993153 r = 0.9996576 Внешний стандарт Средний RF: 2.001672e+007 RF СО: 331384.0 RF %СКО: 1.655536 |
|
Уровень |
Концентрация, мг/мл |
Средняя площадь |
Площадь 1 |
Площадь 2 |
Площадь 3 |
|
1 |
0,05 |
1013907 |
1013676 |
1011798 |
1016247 |
|
2 |
0,1 |
2019115 |
2014528 |
2020407 |
2022411 |
|
3 |
0,15 |
2937130 |
2945730 |
2933428 |
2932232 |
|
в) |
д) |
Y = aX + b a = 4.720793e+007 b = 0.0 R2 = 0.9999995 r = 0.9999998 Внешний стандарт Средний RF: 4.744187e + 007 RF СО: 1613611 RF %СКО: 3.401240 |
|
Уровень |
Концентрация, мг/мл |
Средняя площадь |
Площадь 1 |
Площадь 2 |
Площадь 3 |
|
1 |
0,01 |
483528 |
335186 |
510289 |
456766 |
|
2 |
0,022 |
1038955 |
1049700 |
1043742 |
1023422 |
|
3 |
0,028 |
1317435 |
1304687 |
1338484 |
1309134 |
Рис. 3 а, б, в, д. Хроматограммы модельных смесей, содержащих 5-NO2F и NaAsc, и калибровочные графики действующих веществ: 3 а) – модельной смеси 2, содержащей 0,1 мг/мл 5-NO2F при постоянстве концентраций остальных действующих веществ; 3 б) – калибровочный график по 5-NO2F; 3 в) – модельной смеси 5, содержащей 0,02 мг/мл NaAsc при постоянстве концентраций остальных действующих веществ; 3 д) – калибровочный график по NaAsc. Условия: λ = 310 и 254 нм, объем пробы 20 μL, ν потока 1мл/мин, t = 35 °C
Таблица 1
Результаты количественного определения 5-нитрофурала по методу «введено-найдено»
|
Введено, г |
Найдено, г |
Выход, % |
Метрологические характеристики |
|
0,25 |
0,24 |
96 |
Хср = 100,7 SD = 5,15 RSD = 0,51 % Е = 4,21 % |
|
0,25 |
0,27 |
108 |
|
|
0,25 |
0,26 |
106 |
|
|
0,5 |
0,49 |
98 |
|
|
0,5 |
0,48 |
96 |
|
|
0,5 |
0,52 |
104 |
|
|
0,75 |
0,77 |
102 |
|
|
0,75 |
0,72 |
96 |
|
|
0,75 |
0,76 |
101 |
Таблица 2
Результаты количественного определения натрия аскорбата по методу «введено-найдено»
|
Введено, г |
Найдено, г |
Выход, % |
Метрологические характеристики |
|
0,05 |
0,049 |
98 |
Хср = 100,1 SD = 9,48 RSD = 0,94 % Е = 7,44 % |
|
0,05 |
0,051 |
102 |
|
|
0,05 |
0,048 |
96 |
|
|
0,1 |
0,09 |
90 |
|
|
0,1 |
0,11 |
110 |
|
|
0,1 |
0,12 |
120 |
|
|
0,15 |
0,14 |
93 |
|
|
0,15 |
0,16 |
106 |
|
|
0,15 |
0,13 |
86 |
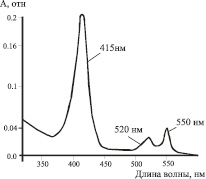
Рис. 4. Электронный спектр cyt c раствора в присутствии натрия аскорбата
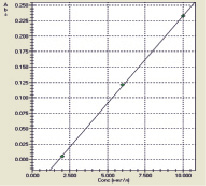
Рис. 5. Зависимость поглощения от концентрации железа
Правильность методики определяли методом «введено-найдено». Отношение количества введенного 5-нитрофурала к найденному (Хср) в % соответствовало 100,7 %, что характеризует разработанную методику как правильную (табл. 1). Величина Хср для NaAsc, рассчитанная по этому методу соответствовала 100,1 %, что определяет правильность методики определения двух компонентов в одной пробе (табл. 2).
Методика удовлетворяет требования по сходимости для обоих анализируемых компонентов – 5-NO2F и NaAsc, о чем свидетельствуют критерии приемлемости RSD % = 0,51 % и RSD % = 0,94 %, соответственно.
Анализ цитохрома с. Идентификацию сyt c в порошке проводили после его растворения в воде и удаления нерастворимого осадка, анализируя видимую область спектра (λ = 410–415, 520, 550 нм).
Количественное определение проводили методом ААС после растворения его в концентрированной азотной кислоте, используя лампу полого катода с λ = 248,33 нм, в газовой среде – аргон. Результаты с использованием калибровочного графика (уравнение Abs = y = 0.0284 CFe-0.0507, где [СFe] = мкг/л) представлены на рис. 5 и в табл. 3.
Как следует из данных табл. 3, значения относительного стандартного отклонения RSD и стандартного отклонения SD малы и составляют 5,5 % и 0,025 %. В соответствии с требованиями руководства [8] эту методику можно считать правильной и воспроизводимой.
Анализ оксида цинка в порошке. Качественный и количественный анализ цинка оксида в порошке проводили методом ААС после растворения его в азотной кислоте, используя лампу полого катода λ = 213,9 нм в газовой среде воздух – ацетилен, 2,2 л∙мин-1. Процедура выполнения пробоподготовки и анализа в целом аналогична анализу железа в цитохроме с. Калибровочный график (уравнение Abs = y = 0.4829СZn – 0,0018, где [СZn] = мг/л приведен на рис. 6.
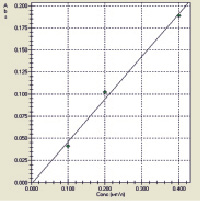
Рис. 6. Зависимость поглощения от концентрации цинка (ААС)
Таблица 3
Результаты анализа железа методом ААС
|
Действие |
Истинное значение концентрации (мкг/л) |
Концентрация (мкг/л) |
Абсорбция |
RSD, % |
SD |
|
STD-1 |
2,000 |
1,7401 |
0,0013 |
6,12 |
0,023 |
|
STD-2 |
2,000 |
2,2892 |
0,0143 |
||
|
STD-3 |
2,000 |
1,8774 |
0,0026 |
||
|
STD-AV |
2,000 |
1,9689 |
0,0052 |
||
|
STD-1 |
6,000 |
5,4533 |
0,1042 |
4,14 |
0,025 |
|
STD-2 |
6,000 |
3,6161 |
0,0520 |
||
|
STD-3 |
6,000 |
6,6711 |
0,1388 |
||
|
STD-AV |
6,000 |
6,0622 |
0,1215 |
||
|
STD-1 |
10,000 |
9,2720 |
0,2127 |
5,58 |
0,027 |
|
STD-2 |
10,000 |
9,5888 |
0,2217 |
||
|
STD-3 |
10,000 |
11,0494 |
0,2632 |
||
|
STD-AV |
10,000 |
9,9689 |
0,2325 |
||
|
Cyt с |
4,4803 |
0,1271 |
6,06 |
0,024 |
|
|
Cyt с |
4,4921 |
0,1123 |
|||
|
Cyt с |
4,4823 |
0,1040 |
Примечание. * аббревиатура STD относится к стандартам, прилагаемым к прибору.
Таблица 4
Результаты анализа цинка методом ААС
|
Действие |
Истинное значение концентрации (мг/л) |
Концентрация (мг/л) |
Абсорбция |
RSD, % |
SD |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
STD-1 |
0,100 |
0,0886 |
0,0410 |
1,20 |
0,005 |
|
STD-2 |
0,100 |
0,0901 |
0,0417 |
||
|
STD-3 |
0,100 |
0,0885 |
0,0409 |
||
|
STD-AV |
0,100 |
0,0895 |
0,0414 |
||
|
STD-1 |
0,200 |
0,2092 |
0,0992 |
4,35 |
0,0045 |
|
STD-2 |
0,200 |
0,2222 |
0,1055 |
||
|
STD-3 |
0,200 |
0,2221 |
0,1054 |
||
|
STD-AV |
0,200 |
0,2158 |
0,1024 |
||
|
STD-1 |
0,400 |
0,3829 |
0,1831 |
4,23 |
0,0080 |
|
STD-2 |
0,400 |
0,4063 |
0,1944 |
||
|
STD-3 |
0,400 |
0,3820 |
0,1829 |
||
|
STD-AV |
0,400 |
0,3947 |
0,1888 |
||
|
Zn |
0,3875 |
0,1853 |
3,17 |
0,0060 |
|
|
Zn |
0,4051 |
0,1938 |
|||
|
Zn |
0,3964 |
0,1896 |
Примечание. * аббревиатура STD относится к стандартам, прилагаемым к прибору.
Как следует из данных табл. 4 значений относительного стандартного отклонения RSD и стандартного отклонения SD, составляющих 3,2 % и 0,006 %, методику определения цинка в порошке можно считать правильной и воспроизводимой.
Выводы
1. Разработана методика УФ – спектрального и ВЭЖ- хроматографического анализов 5-нитрофурала и натрия аскорбата. Рекомендовано:
1) пробоподготовку для анализа проводить растворением порошка в смеси ацетонитрил:фосфатный буферный раствор pH 6 в объемном соотношении 27:73 и удалением нерастворимого осадка цитохрома с, оксида цинка и крахмала фильтрацией.
2) идентификацию 5-нитрофурала выполнять УФ – спектроскопически, анализируя полученный водно-ацетонитрильный раствор (λ = 310 нм) и, сопоставляя этот спектр со спектром аци-соли, полученной добавлением 30 % гидроксида натрия (λ = 420 нм).
3) ОФ ВЭЖХ анализ (идентификацию и количественное определение) 5-нитрофурала и натрия аскорбата проводить при λ = 310 нм на колонке Discovery C18 (250×4,6 mm, 5 μm) в изократическом режиме при t = 35 °C c использованием стандартных растворов. Время выхода пика 5-нитрофурала – 4,8 мин, натрия аскорбата – 2,9 мин.
2. Разработана методика анализа цитохрома с в порошке. Рекомендовано:
а) идентификацию проводить после его растворения порошка в воде, анализируя видимый область спектра (λ = 410–415, 520, 550 нм);
б) количественное определение выполнять методом ААС после растворения его в концентрированной азотной кислоте, используя лампу полного катода с λ = 248,33 нм, в газовой среде – аргон.
3. Разработана методика качественного и количественного анализа цинка оксида в порошке методом ААС в соответствии с которой после растворения его в азотной кислоте, выполнять анализ используя лампу полного катода λ = 213,9 нм в газовой среде воздух – ацетилен, 2,2 л мин –1.
4. Проведена валидационная оценка методов количественного определения по показателям правильность, воспроизводимость, линейность и сходимость 5-нитрофурала, натрия аскорбата, цитохрома с, цинка оксида в порошке.