За последние годы произошли существенные изменения в экосистеме реки Аргунь, воды которой в настоящее время имеют самое низкое качество на территории Забайкальского края. Низкий класс качества обусловлен зимним дефицитом растворенного в воде кислорода, содержание которого в отдельные периоды составляет 0,6-2,09 мг/л. Также наблюдается превышение ПДК по ряду компонентов: фенолам, СПАВ, фторидам и т.д. [2, 16, 17]. Изменения климата привели в свою очередь к изменению ледового режима и внутригодового распределения стока [13]. Произошедшие изменения в р. Аргунь привели к возникновению ряда экологических проблем, которые оказывают отрицательное воздействие на рыбное сообщество [3, 5]. Кроме природных особенностей бассейна на состояние водных экосистем влияние оказывает деятельность человека, в том числе и добыча россыпного золота [1, 7, 9, 11, 14].
В последние годы отмечены значительные изменения в составе ихтиофауны как самой реки, так и ее притоков. Отмечается уменьшение численности ценных видов рыб, наблюдаются процессы саморасселения рыб, появление новых видов, которые ранее здесь отсутствовали. Отмечается рост численности горчака не только в р. Аргунь но и крупных притоках, таких как Газимур.
Наиболее подробные сведения о рыбах р. Аргунь и ее притоков можно найти в работах Таранца А.Я. (1937)[15], Никольского Г.В. (1956) [12], Карасева Г.Л. (1987), [10]. Эти сведения в основном касаются биологии основных видов рыб. Современные сведения о рыбном населении данной реки были получены в 2013 году. Кроме этого были использованы материалы 2005 года, а также сведения по ихтиофауне полученные во время оценки тех или иных видов деятельности (водозаборы, создание водохранилищ, мостовых переходов и т.д.).
В последние годы, в связи с тем, что река носит трансграничный характер, антропогенное воздействие на нее возросло многократно. В настоящее время р. Аргунь внесена в «Приоритетный список водных объектов, требующих первоочередного осуществления водоохранных мероприятий»., которые отнесены к наиболее грязным».
Целью данной работы является оценка изменений в составе рыбного населения р. Аргунь и ее притоков под влиянием хозяйственной деятельности и возрастающей антропогенной нагрузки
Материалы и методы исследования
В ходе работы были использованы собственные и литературные данные, а также фондовые материалы ИПРЭК СО РАН, полученные во время экспедиционных исследований. Основной объем ихтиологических работ проводился в 2006, 2013 гг. как на самой р. Аргунь, так и основных притоках, Урюмкан, Будюмкан, Уров, Серебрянка, источнике Соктуй-Милозан, а также Краснокаменском водохранилище. Состав ихтиофауны изучен при помощи постановки ставных жаберных сетей (ячеей 12-60 мм), малькового невода и ловушек.
Результаты исследования и их обсуждение
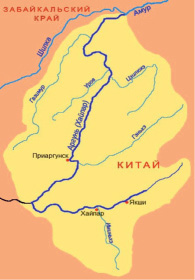
Аргунь является правой составляющей р. Амур и относится к верхнеамурскому бассейну. Река берет начало в отрогах Большого Хингана (рис. 1). Общая длина реки составляет 1683 км, из которых 951 км в пределах Забайкальского края. Общая площадь водосбора – 164 тыс. км2, в Забайкальском крае – 49,1 тыс. км2 . Река Аргунь имеет ряд крупных притоков Газимур, Урюмкан, Будюмкан, Уров. Ср. и Н. Борзя. В 1974 г. было образовано Краснокаменское водохранилище, поддержание водного баланса которого связано с перекачкой воды из р. Аргунь.
В настоящее время, в связи с возрастающим антропогенным воздействием, остро стоит проблема загрязнения вод р. Аргунь и оценка современного состояния ихтиофауны данного бассейна. Анализ природно-ресурсного потенциала территории, видового разнообразия рыб и структурной перестройки ихтиоценозов позволил оценить современное состояние водных экосистем бассейна р. Аргунь, от слабо до сильно трансформированных [3].
Общая характеристика рыбного сообщества бассейна р. Аргунь
|
|
Основные изменения ихтиоценозов р. Аргунь при антропогенном влиянии 1. Исчезновение осетровых 2. Ухудшение условий обитания представителей арктического пресноводного комплекса 3. Сокращение ареалов и численности массовых видов рыб 4. Снижение видового разнообразия 5. Появление чужеродных видов 6. Снижение размерно-весовых показателей 7. Потери рыб, ведущих придонный образ жизни 8. Потери промышленного рыболовства 9. Утрата нерестилищ 10. Сокращение фитофильных видов рыб |
А Б
Рис. 1. А – Карта–схема р. Аргунь; Б – основные изменения ихтиоценозов
За последние годы отмечается резкое снижение численности многих видов рыб, или их исчезновение из состава ихтиофауны. За время исследований в ихтиофауне реки нами было зарегистрировано 28 видов рыб. Хотя в середине прошлого столетия этот список был представлен 35 видами рыб (табл. 1). Таранец А.Я. (1937) [15] и Никольский Г.В. (1956) [12] приводят список из 24 видов. Очевидно, это связано с тем, что в их работах приводятся данные по отдельным участкам, а не по всему бассейну. Всего в ихтиофауне всеми авторами было зарегистрировано 39 видов.
В составе рыбного населения р. Аргунь встречаются, как широко распространенные виды рыб (таймень, ленок, амурский хариус, гольян обыкновенный, гольян Чекановского, сибирский пескарь, карась, сибирский голец, щиповка, налим), так и виды широко распространенные в Амуре, но отсутствующие к западу от Яблонового хребта (сиг-хадары, амурский чебак, амурский плоскоголовый жерех, амурский чебачек, конь-губарь, амурский сом, владиславия, амурская щука, амурская широколобка). Есть виды, имеющие прерванный ареал – это такие виды как карп, вьюн горчак.
Таблица 1
Видовой состав рыб и рыбообразных р. Аргунь
|
Вид |
Таранец (1937) [15] |
Никольский (1956) [12] |
Карасев (1987) [10] |
Наши данные |
|
Дальневосточная ручьевая минога Lethenteron reissneri (Dybowski, 1869 |
_ |
+ |
+ |
|
|
Калуга Huso dauricus (Georgi, 1775) |
+ |
+ |
+ |
– |
|
Кета Oncorhynchus keta (Walbaum,1972) |
+ |
+ |
– |
– |
|
Амурский осетр Acipenser schrenckii Brandt, 1869 |
+ |
+ |
+ |
– |
|
Таймень Hucho taimen (Pallas,1773) |
+ |
+ |
+ |
+ |
|
Ленок Brachymystax lenok (Pallas, 1773) |
+ |
+ |
+ |
+ |
|
Сиг-хадары Coregonus chadary Dybowski, 1862 |
+ |
+ |
+ |
– |
|
Амурский хариус Thymallus arcticus grubei Dybowski, 1869 |
+ |
+ |
+ |
– |
|
Амурская щука Esox reichertii Dybowski, 1869 |
+ |
+ |
+ |
– |
|
Амурский чебак Leuciscus waleckii (Dybowski, 1869) |
+ |
+ |
+ |
+ |
|
Озерный гольян Phoxinus perenurus (Pallas, 1814) |
+ |
+ |
+ |
+ |
|
Гольян Чекановского Phoxinus czekanowskii Dybowskii, 1869 |
+ |
+ |
+ |
+ |
|
Гольян Лаговского Phoxinus lagowskii Dybowski, 1869 |
+ |
+ |
+ |
+ |
|
Обыкновенный гольян Phoxinus phoxinus (Linnaeus, 1758) |
+ |
+ |
+ |
+ |
|
Амурский плоскоголовый жерех Pseudaspius leptocephalus (Pallas, 1776) |
+ |
+ |
+ |
+ |
|
Амурский чебачек Pseudorasbora parva (Temminck et Schlegel, 1846) |
+ |
+ |
+ |
+ |
|
Сибирский пескарь Gobio gobio cynocephalus Dybowski, 1869 |
+ |
+ |
+ |
+ |
|
Пескарь Солдатова Gobio soldatovi Berg, 1914 |
– |
– |
+ |
– |
|
Белоперый амурский пескарь Romanogobio tenuicorpus (Mori, 1934) |
– |
– |
+ |
+ |
|
Маньчжурский пескарь |
+ |
+ |
||
|
Владиславия Ladislavia taczanowskii Dybowski, 1869 |
– |
– |
+ |
+ |
|
Амурский носатый пескарь Microphysogobio tungtingensis amurensis (Taranetz,1937) |
+ |
+ |
– |
|
|
Пескарь-губач Черского Sarcocheilichthys czerskii (Berg, 1914) |
– |
– |
+ |
+ |
|
Конь-губарь Hemibarbus labeo (Pallas, 1776) |
– |
+ |
+ |
+ |
|
Подуст-чернобрюшка Xenocypris argentea (Basilewsky, 1855) |
– |
– |
+ |
+ |
|
Востробрюшка Hemiculter leucisculus (Basilewsky, 1859) |
+ |
– |
+ |
+ |
|
Амурский горчак Rhodeus sericeus sericeus (Pallas, 1776) |
+ |
+ |
+ |
+ |
|
Карась серебряный Carassius auratus gibelio (Bloch, 1782) |
+ |
+ |
+ |
+ |
|
Амурский сазан Cyprinus carpio haematopterus Temminck et Schlegel, 1846 |
+ |
+ |
+ |
+ |
|
Белый толстолобик Hypophthalmichthys molitrix (Valenciennes, 1844) |
– |
– |
+ |
– |
|
Ротан Perccottus glenii Dybowski, 1877 |
– |
– |
– |
+ |
|
Ханкинский пескарь Scualidus chankaensis Dybowski, 1872 |
– |
– |
+ |
+ |
|
Сибирский голец Barbatula toni (Dybowski, 1869) |
+ |
– |
– |
+ |
|
Сибирская щиповка Cobitis melanoleuca Nichols, 1925 |
+ |
+ |
+ |
+ |
|
Амурский сом Parasilurus asotus (Linnaeus, 1758) |
+ |
+ |
+ |
+ |
|
Налим Lota lota (Linnaeus, 1758) |
+ |
+ |
+ |
+ |
|
Амурская широколобка Mesocottus haitej (Dybowski, 1869) |
– |
– |
+ |
– |
|
Пестроногий подкаменщик Cottus czanaga Dybowski, 1869 |
– |
– |
+ |
– |
|
Лефуа Lefua costata (Kessler, 1876) |
– |
– |
– |
+ |
В состав ихтиофауна р. Аргунь входят представители различных фаунистических комплексов: бореально равнинного, бореально- предгорного, древнего верхнетретичного, арктического, индийского, китайского фаунистических комплексов. В результате сильного антропогенного воздействия наибольшую нагрузку испытывают представители бореально-предгорного комплекса (ленок, таймень, амурский хариус, амурская широколобка) и представители арктического комплекса (налим, сиг-хадары). Как следствие, за период исследований нами не обнаружены в уловах сиг-хадары и амурская широколобка, которые в предыдущие годы были довольно многочисленными [4, 6]. Наиболее благоприятными условиями для данных видов можно считать нижнее течение Аргуни, куда впадают крупные реки Газимур, Будюмкан, Урюмкан. Однако, именно здесь планируется строительство ряда горно-обогатительных комбинатов. Все это приведет к потере нерестилищ и уменьшению видового разнообразия. Также нами не обнаружена амурская щука, которая ранее считалась наиболее многочисленным и широко распространенным хищником. Именно щука оказывала влияние на стадо карася, чебака, подуста-чернобрюшки, востробрюшки, пескарей, снижая их численность. Очевидно, что отсутствие щуки привело к быстрому распространению ротана по бассейну Аргуни и появлению других представителей китайского фаунистического комплекса в составе ихтиофауны [8].
В 2013 г. впервые в притоке р. Аргунь р. Серебрянка и источнике Соктуй-Милозан была зарегистрирована лефуа, находки которой относятся только к оз. Зун-Торей и Барун-Торей (рис. 2). В своей работе Таранец А.Я [15] указывает, что данный вид распространен в бассейне нижнего Амура и Сунгари, а с другой в бассейне оз. Далай-Нор во внутренней Монголии, куда он проник из бассейна Амура, вследствие чего может оказаться в бассейне Аргуни.
Кроме этого в составе ихтиофауны Краснокаменского водохранилища появился новый вид ханкинский пескарь, который ранее авторами не отмечался. Ханкинский пескарь является эндемиком Амура и особенно многочислен в южной части ареала: Уссури и оз. Ханка [12]. В Забайкалье впервые отмечен в 1961 г в среднем течение р. Онон, а в 1970-1971 гг. – в рр. Шилка и Аргунь, где распространен локально и является малочисленным. Исследования 2014 года показали, что численность данного вида в водохранилище возросла. Популяция ханкинского пескаря Краснокаменского водохранилища представлена короткоусой и большеглазой формой. Ханкинский пескарь из Краснокаменского водохранилища характеризуется более высокими показателями линейно-весового роста.
Это указывает на то, что здесь он нашел для себя более благоприятные условия существования. Питается данный вид личинками хирономид, конкурируя тем самым с промысловыми видами рыб (рис. 3). Ханкинский пескарь Краснокаменского водохранилища по своим морфологическим показателям приближается к ханкинскому пескарю из бассейна Нижнего Амура, что косвенно указывает на естественное расширение ареала данного вида.


А Б
Рис. 2. Лефуа из источника Соктуй-Милозан: А – места находок; Б – лефуа
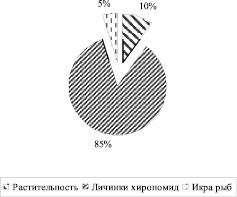
Рис. 3. Состав пищи ханкинского пескаря Краснокаменского водохранилища

А Б
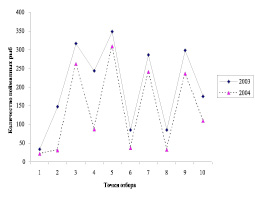
Рис. 4. А – вид реки Ср. Борзя; Б – распределение рыб по профилю реки (точки 4, 6, 8 – места, нарушенные работами драг и гидромониторов)
Серьезный вред на рыбное население оказывают предприятия золотодобычи. На сегодняшний день от естественного русла р. Средняя Борзя осталась ненарушенным его верхнее течение в пределах 10-15 км. В конце прошлого столетия этот участок составлял где-то 50-60 км (рис. 4). Исследования, проведенные в 2003-2004 гг. на р. Средняя Борзя показали, что численность рыб ниже работы гидромониторов и драг снижается в 3-5 раз. (рис. 4) Также происходит перестройка структуры рыбных сообществ. Образовавшиеся карьеры по р. Средняя Борзя заселились видом-вселенцем ротаном-головешкой.
По мере продвижения драг и гидромониторов значительная часть видов рыб также поднимается вверх на чистые участки. Обыкновенный гольян может служить индикатором состояния рек, на которых ведется золотодобыча, так как он одним из первых видов покидает зону мутности, которая образуется после работы гидромониторов и драг.
Браконьерский вылов рыбы, а также перелов в середине 60-х годов привели к тому, что река потеряла свое рыбохозяйственное значение. Вылов рыбы в 60-х годах составил 600 т, причем в уловах преобладал сазан, в настоящее время значительная доля принадлежит амурскому чебаку и ротану, а также мелким представителям китайского фаунистического комплекса.
Характеристика наиболее распространенных видов рыб
В период исследований наиболее многочисленными были следующие виды рыб сазан, карась серебряный, амурский чебак. Ниже дается характеристика данных видов.
Ареал распространения амурского сазана охватывает равнинные участки рек. Поэтому наиболее часто сазан отмечался нами в р. Аргунь в р-не Прорвы, Кайлайстуя.
Амурский сазан имеет довольно высокий рост в водоемах Забайкальского края. Однако линейно-весовые показатели в р. Аргунь по сравнению с 60-ми годами прошлого столетия снизились в 3-4 раза (рис. 5).
В начале прошлого столетия сазан из реки Аргунь был пересажен в оз. Кенон, Ивано-Арахлейские озера, озера Еравно-Харгинской системы и Гусино-Убукунской. В настоящее время такие пересадки должны быть запрещены. Дело в том, что исследованиями 2013 г. установлено, что на протяжении всего бассейна реки отмечается ротан крайне агрессивный и нежелательный вид в составе ихтиофауны.
Чебак, амурский язь распространен от бассейна Амура на севере до Хуанхэ на юге. Бока тела серебристые, спина, спиной и хвостовой плавники серовато-коричневые, парные и анальные плавники – желтоватые. Нерест происходит сразу после вскрытия рек на песчано-галечных грунтах, поросших травой, с конца апреля до начала мая. По типу питания – эврифаг. Широко распространенный промысловый вид в водоемах Амурского бассейна. Объект любительского рыболовства.
Показатели линейно-весового роста чебака даны в табл. 2. Полученный материал показывает, что по сравнению с 70-ми годами прошлого столетия темп роста амурского чебака снизился в 2 – 2,5 раза. В уловах преобладали особи в возрасте 4+ и 5+ (30,6 % и 34, 7 % соответственно). Упитанность рыб колебалась от 1,45 до 2,05. В тоже время в районе протоки Прорва ростовые характеристики остаются близкими с данными Карасева Г.Л. (1987) [10], полученными в начале 70-х годов прошлого столетия.
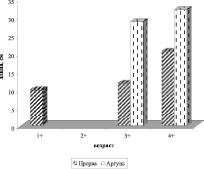
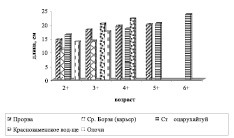
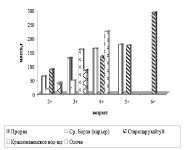
Сравнение материалов по росту чебака по профилю реки показало, что наиболее быстро амурский чебак растет в р-не Прорвы и с. Староцарюхайтуя и наиболее медленно в карьерах по Ср. Борзе (рис. 6).
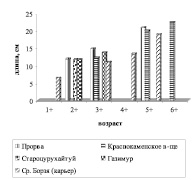
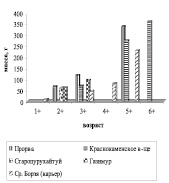
Карась широко распространен в бассейне р. Аргунь. Нами был отмечен как в самом русле реки, так и его притоках, Краснокаменском водохранилище, карьерных водоемах по р. Средняя Борзя. Наилучшие показатели роста наблюдались в районе Прорвы и Краснокаменском водохранилище. В связи с тем, что в карьерных водоемах складываются неблагоприятные условия для жизнедеятельности рыб в карьерных водоемах по р. Ср. Борзя и р. Газимур отмечаются самые низкие показатели роста карася серебряного (рис. 7).
Основные биотопы обитания гольяна Лаговского – это горные речки и ручьи. Сравнение линейно-весовых показателей из разных водотоков Верхнеамурского бассейна показало, что в р. Уров и Газимур гольян Лагоаского растет быстрее, чем в р. Онон и Шилка. (рис. 8).

А Б
Рис. 5. А – линейный рост сазана; Б – весовой рост сазана в бассейне р. Аргунь
Таблица 2
Линейно-весовые показатели и упитанность амурского чебака р. Аргунь (протока Прорва) в 2013 году
|
Показатели/возраст |
2+ |
3+ |
4+ |
5+ |
|
L1, мм |
132-160 144 |
180-182 181 |
190-198 193 |
200 |
|
L2, мм |
160-190 169 |
210-215 213 |
220-230 225 |
230-235 232 |
|
Q1, г |
47-81 63 |
123-132 128 |
151-175 161 |
151-196 176 |
|
Q2, г |
39-70 53 |
105-109 107 |
127-145 135 |
128-166 145 |
|
Уф |
1,36-2,37 1,84 |
2,11-2,19 2,15 |
2,20-2,25 2,22 |
1,89-2,45 2,20 |
|
Ук |
1,23-2,04 1,69 |
1,80-1,81 1,81 |
1,85-1,87 1,86 |
1,60-2,08 1,81 |
|
Количество, экз. |
20 |
2 |
3 |
5 |
Примечания. L1 – длина всей рыбы: L2 – длина промысловая; Q1 – вес всей рыбы; Q2 – вес рыбы без внутренностей; Уф – упитанность по Фультону; Ук – упитанность по Кларку.
А Б
Рис. 6. А – линейный рост ; Б – весовой рост амурского чебака в бассейне р. Аргунь
А Б
Рис. 7. А – линейный; Б – весовой рост карася серебряного различных водоемов и водотоков бассейна р. Аргунь
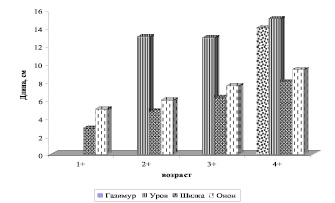
Рис. 8. Линейный рост гольяна Лаговского из разных водотоков Верхнеамурского бассейна
Заключение
За последние 50-60 лет произошло уменьшение видового разнообразия рыб р. Аргунь. Отмечается изменение структуры рыбного сообщества реки. Усилившаяся антропогенная нагрузка привела к снижению кормовой базы и уменьшению линейно-весового роста рыб. В уловах не были зарегистрированы калуга, амурский осетр, сиг-хадары, крайне редко отмечалась амурская щука. В составе ихтиофауны появились новые виды, такие как ротан-головешка, в Краснокаменском водохранилище зарегистрированы ханкинский и маньчжурский пескари, которые расширили свой ареал обитания. Виды вселенцы оказываются более адаптированными к воздействию различных загрязнений, по сравнению с аборигенной ихтиофауной. Наиболее неблагоприятные условия для обитания рыб отмечаются в местах золотодобычи, строительства мостовых переходов, водозаборов.
Для сохранения уникальной ихтиофауны р. Аргунь и Амурского бассейна в целом необходимо проведение мер по улучшению экологической обстановки, соблюдение жестких мер при рыбоводных работах, усиление рыбоохранных мероприятий
Работа представлена по материалам, полученным в рамках выполнения интеграционного проекта СО РАН – УрО РАН – ДВО РАН «Трансграничные речные бассейны в Азиатской части России: комплексный анализ состояния природно-антропогенной среды и перспективы межрегиональных взаимодействий» и Гос. задания по теме (проекту) № 79.1.2. «Динамика природных и природно-антропогенных систем в условиях изменения климата и антропогенной нагрузки (на примере Забайкалья)».