По данным ВОЗ, более 20 % населения Земли страдает кожными заболеваниями. При лечении такого рода заболеваний наряду с общей терапией широко используются лекарственные средства наружного применения. В зависимости от рода заболевания, приемлемыми являются различные лекарственные формы: от примочек до мазей. Правильно подобранный состав лекарственного средства действует на течение заболевания в ряде случаев более интенсивно, чем основное действующее вещество. С другой стороны, зачастую, какой-либо из компонентов – вспомогательных веществ или основы, может не просто обесценить действие лекарственного вещества, но и усугубляет проявление болезни.
Лекарственные формы на основе жирных масел представляют особый интерес для дерматологии в связи с богатым химическим составом. В настоящей работе рассматривается фитокомпозиция на основе масла семян тыквы Cucurbita Pepo. Биологически активные вещества в составе масла благоприятным образом влияют на течение дерматологических заболеваний: необходимый баланс жирных кислот, а также высокое содержание токолов, каротиноидов и фитостеролов в тыквенном масле делают его перспективным компонентом в составе сложных фармацевтических композиций. Для усиления противовоспалительного действия в состав фитокомпозиции нами предложено вводить бетулин – пентациклический тритерпеноид, основной компонент бересты березы. По химической структуре бетулин близок к глюкокортикостероидам, но в отличие от них не проявляет известных побочных эффектов и не вызывает привыкания. Высокая противовоспалительная активность соединения, а также его репаративные свойства, подтвержденные в ряде работ [1, 2, 3], обосновывают актуальность его введения в разрабатываемую композицию. С целью стабилизации композиции, в ее состав предложено вводить вещество, имеющее высокий антиоксидантный потенциал. В качестве такого соединения был использован тимол – монотерпеновый фенол, основной компонент эфирных масел тимьяна ползучего и душицы обыкновенной. Кроме антиоксидантного действия (защита токолов и каротиноидов в составе масла семян тыквы), тимол в данной композиции является сорастворяющим агентом для бетулина, вероятно, образуя с ним комплексы включения.
Предложенная фармацевтическая композиция имела следующий состав (масс. %): бетулин – 2.1, тимол – 6.4, масло семян тыквы (МСТ) – до 100.0 и может быть введена в состав сложных лекарственных форм.
Количественное определение ингредиентов в фитокомпозиции является крайне трудной аналитической задачей, поскольку МСТ имеет многокомпонентный состав, быстро окисляется, а проведение анализа как растительных масел, так и активных действующих веществ в композиции сопряжено со значительными сложностями. Для таких масел, как МСТ, основную трудность представляет собой пробоподготовка, которую обычно осуществляют омылением водными или спиртовыми растворами щелочей. В процессе омыления в жестких условиях (высокая температура смеси в течение продолжительного времени) возможны не только окисление, но и деструкция ценных биологически активных веществ, вследствие чего требуется защита компонентов от нежелательных процессов. В международном протоколе анализа Current Protocols in Food Analytical Chemistry, 2001 для жирных масел в качестве такой защиты используется аскорбиновая кислота. Однако, в случае анализа ряда масел, в том числе МСТ, введение аскорбиновой кислоты не позволяет обеспечить стабильность композиции.
С другой стороны, количественное определение компонентов (более 20 в МСТ), несмотря на многочисленные публикации [4, 5, 7, 10] также являются нерешенной задачей, и в настоящее время отсутствуют унифицированные методики анализа наиболее ценных компонентов в МСТ.
Цель данной работы – разработка и валидация методик количественного определения компонентов, оказывающих основное влияние на воспалительный процесс, по суммарному содержанию каротиноидов, токоферолов и β-ситостерола, и бетулина в фитокомпозиции бетулина и тимола в масле семян тыквы.
Материалы и методы исследования
Материалы и реактивы. ( ± )α-токоферол (Supelco, 47783), рац-β-токоферол (50 мг/мл в гексане, Supelco, 46401-U), γ-токоферол (Supelco, 47785), δ-токоферол(Supelco, 47784), β-каротин (Sigma, 22040), β-ситостерол 95 %, масло семян тыквы (ФСП 42-8110-06), бетулин98 % (Sigma, 473-98-3), ацетонитрил для хроматографии сорт 0 (ТУ 2636-040-44493179-00), гидроксид калия марки х.ч. (ГОСТ 24363-80), азот, оксид магния марки х.ч. (ГОСТ 4526-75), аскорбиновая кислотамарки х.ч. (ГОСТ 4815-76), тимолмарки х.ч. (ТУ 6-09-3736-79), этанол марки о.с.ч., гексан марки х.ч., метанол марки о.с.ч, дихлорметан марки о.с.ч., вода очищенная, полученная на установке «Elix-3» фирмы «MILLIPORE», удельное сопротивление менее 0,2 µСм.
Анализ электронных спектров был выполнен на UV-vis спектрофотометреSpecordS100 Bioline (Analytic Jena, Германия), толщина кварцевой кюветы 10 мм. Измеряли оптическую плотность в интервале длин волн 330 – 800 нм стандартных растворов и испытуемого раствора трижды. Гексановый экстракт предварительно пропускали через колонку, заполненную оксидом магния. Использовали гексан в качестве раствора сравнения. Для построения калибровочной кривой измеряли оптическую плотность на длине волны λmax = 424 нм от базовой линии, вычисляя значения средней оптической плотности.
Суммарное содержание каротиноидов (в мг) на 100 г композиции (мг %) рассчитывали по формуле:
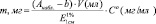
где Анабл. – оптическая плотность исследуемого раствора композиции в гексане; b – поправка оптической плотности по отношению к базовой линии; V – анализируемый объем раствора, мл; 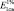 – удельный коэффициент экстинкции; С °– концентрация 1 % раствора, равная 10 мг/мл.
– удельный коэффициент экстинкции; С °– концентрация 1 % раствора, равная 10 мг/мл.
ВЭЖХ-анализ бетулина, токоферолов и β-ситостерола проводили на высокоэффективном жидкостном хроматографе марки Shimadzu LC-10 Avp в обращенно-фазовом режиме, колонка Discovery C18 (250×4.6 mm, 5μm) с диодно-матричным УФ-детектором. Условия хроматографирования бетулина: подвижная фаза ацетонитрил—вода 90:10 (υ/υ) в изократическом режиме при скорости потока 1 мл/мин при температуре 40 °C, объем инжекции 20 μL, детектирование при длинах волн 206 и 210 нм, время анализа 20 мин. Условия хроматографирования токоферолов: подвижная фаза метанол-ацетонитрил-дихлорметан 50:44:6 (υ/υ) в изократическом режиме при скорости потока 1 мл/мин при температуре 30⁰C, объем инжекции 20 μL, детектирование при длине волны 284 нм, время анализа 30 мин.Условия хроматографирования β-ситостерола: подвижная фаза спирт этиловый 96 %-ацетонитрил 15:85 (υ/υ) в изократическом режиме при скорости потока 1 мл/мин при температуре 40 °C, объем инжекции 20 μL, детектирование при длине волны 210 нм, время анализа 30 мин.
Приготовление стандартных растворов из стандартов
|
Стандарт исходный |
С0, % |
С, стандартных растворов |
|
МСТ |
100 |
0.01; 0.02; 0.03 гмл |
|
α-токоферол |
100 |
1.02; 4.08; 10.20; 51.00 мгл |
|
γ-токоферол |
0.005 |
1.0; 4.0; 10.0; 50.0 мгл |
|
β-ситостерол |
95 |
0.052; 0.078;0.260 мгмл |
|
бетулин |
98 |
0.063; 0.125; 0.250; 0.500; 1.000 мгмл |
Приготовление модельных смесей 1, 2, 3: 0.1 г (точная навеска) бетулина помещали в ступку, перетирали с добавлением 1 мл спирта этилового 96 %, добавляли 0.5 г тимола, 0.2 г аскорбиновой кислоты, при перемешивании вводили 0.5; 1.0 и 2.0 г МСТ. Смесь перетирали пестиком до однородной суспензии. Перед анализом на наличие токоферолов и фитостеролов смесь омыляли согласно приведенной ниже методике.
Приготовление модельных смесей 4, 5, 6 выполняли аналогично процедуре приготовления модельных смесей 1,2,3, используя 0.05 г; 0.1 г; 0.15 г (точной навески) бетулина. Состав смеси: 0.5 г тимола; 0.2 г аскорбиновой кислоты; 2.0 г МСТ. Перед анализом на наличие токоферолов и фитостеролов смесь омыляли согласно приведенной ниже методике.
Методика пробоподготовки образцов для анализа токоферолов и фитостеролов:
Модельную смесь растворяют в 50 мл спирта этилового 96 %, добавляют 30 мл 60 масс. % водного раствора КОН и выдерживают образец в течение 30 мин на водяной бане при 70 °C, периодически перемешивая. После указанного времени к смеси, разделившейся на 2 фазы (нижняя – розоватая, верхняя – желтая), после охлаждения добавляют 100 мл воды очищенной (смесь становится гомогенной) и экстрагируют полученный раствор двумя порциями гексана по 100 мл, взбалтывая фазы каждый раз в течение 1 минуты. Полученное гексановое извлечение обрабатывают 100 мл 1 % раствора аскорбиновой кислоты, а затем дважды водой порциями по 100 мл, после чего осушают полученный раствор безводным Na2SO4. Гексан удаляют в токе азота до остаточного объема 15 мл и полученный раствор пропускают через колонку с MgO диаметром 1.5 см, высотой 5 см для очистки от каротиноидов. Колонку промывают двумя порциями гексана по 25 мл и полученный гексановый раствор отгоняют в токе азота досуха. Сухой остаток растворяют в 1 мл элюента.
Статистическую обработку проводили по программе Statistica 7.0 (р < 0.05).
Результаты исследования и их обсуждение
UV-Vis – анализ количественного содержания каротиноидов в композиции.
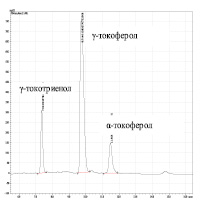
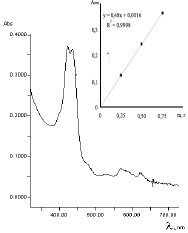
На рис.1 представлена типичная картина электронного спектра гексанового раствора композиции. В спектре наблюдались основные полосы с максимумами поглощения 424 и 434 нм. Каротиноиды, поглощающие в этой области спектра, преимущественно представлены каротиноидами β-ряда, а именно, β-криптоксантином, зеаксантином и виолаксантином [6]. Как правило, каротиноиды образуются путем перехода гидроксилированных каротиноидов в эпоксисоединения (виолаксантин), или возможным дальнейшим окислением и отщеплением эпоксигруппы [8]. Кроме того, в присутствии аскорбиновой кислоты на свету возможно фотовосстановление каротиноидов (образование атероксантина и зеаксантина). Анализ интенсивности поглощения в области 424 и 434 нм, в которой поглощают все каротиноиды, позволяет количественно оценить суммарное содержание каротиноидов в МСТ.
Для удаления следов хлорофилловых соединений, поглощающих в области 550-650 нм, нами проводилась адсорбционная очистка гексанового раствора с использованием колонки, заполненной адсорбентом основного характера. Показано, что наиболее полная очистка достигается при использовании оксида магния.
Калибровочные графики зависимостей интенсивностей поглощения А при 424 и 434 нм от концентрации МСТ имеют линейный характер. На рис. 1 (б) представлена зависимость А = f(m) по λ = 424 нм, соответствующая уравнению y = 0.4800x + 0.0016 (R2 = 0.9998), на основании которой рассчитан 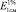 , равный 2515.
, равный 2515.
Суммарное содержание каротинов (в мг) на 100 г МСТ, рассчитанное по формуле 1, равно 0.0483 ± 0.0013мг % (48.3 мкг %). Валидационные характеристики по показателям линейности, сходимости, правильности представлены в табл. 1, 2.
|
Масса МСТ, г |
Оптическая плотность А (424 нм) |
|
0.25 |
0.1216 |
|
0.50 |
0.2416 |
|
0.75 |
0.3616 |
Рис. 1. Электронные спектры гексановых растворов каротиноидов – раствор композиции в гексане; врезка – зависимость A = f (CМСТ)
Таблица 1
Определение сходимости методики количественного определения суммы каротиноидов в композиции по модельным смесям
|
Показатели |
Повторность |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
Сумма каротиноидов, мкг % |
24.0 |
24.3 |
23.8 |
47.9 |
48.1 |
47.5 |
96.4 |
95.6 |
95.8 |
|
Хср. |
24.01 |
47.80 |
95.93 |
||||||
|
RSD, % |
1.06 |
0.64 |
0.44 |
||||||
Таблица 2
Результаты установления правильности методики количественного определения каротиноидов в МСТметодом добавок
|
С каротиноидов, мкг % |
Добавлено СО каротина, мкг % |
Рассчитано, мкг % |
Найдено, мкг % |
Выход, (Открываемость) % |
|
24 |
10 |
34 |
32.3 |
95.0 |
|
24 |
10 |
34 |
31.8 |
93.5 |
|
24 |
10 |
34 |
33.4 |
98.2 |
|
48 |
20 |
68 |
67.8 |
99,7 |
|
48 |
20 |
68 |
65.3 |
96,0 |
|
48 |
20 |
68 |
66.4 |
97.7 |
|
96 |
30 |
126 |
125.7 |
99.8 |
|
96 |
30 |
126 |
126.1 |
100.1 |
|
96 |
30 |
126 |
126.5 |
100.4 |
|
Хср. = 97.81 % |
||||
Определение линейности проводили на 3 уровнях концентраций от ожидаемого содержания суммы каротиноидов в композиции. Критерием приемлемости и линейности методики является коэффициент корреляции, величина которого R2 = 0.9998, следовательно, в анализируемой области концентраций методика является линейной (рис. 1).
|
а) время омыления 30 мин |
б) время омыления 1 час |
||||||||||||||||||||
|
|||||||||||||||||||||
|
Рис. 2. ВЭЖ-хроматограммы композиции с различным временем омыления: а) 30 мин и б) 1 час. Элюент – 44:50:6, v/v (ацетонитрил:метанол:дихлорметан), скорость потока 1.0 мл/мин, УФ-детектор (284 нм), 30 °С |
|||||||||||||||||||||
Сходимость методики определяли в 3 повторностях. Критерий приемлемости, выражаемый через величину относительного стандартного отклонения (RSD, %), составляющей 0.71 % (табл. 1), удовлетворяет требованиям методики по параметру сходимости.
Правильность методики устанавливали методом добавок «введено-найдено» путем измерения количественного содержания суммы каротиноидов в растворах при добавлении определенного количества стандарта к исследуемому раствору. Отношение количества введенного β,β-каротина к найденному (Хср) в % соответствовало 97,81 %, что характеризует разработанную методику как правильную (табл. 2).
ОФ-ВЭЖХ– анализ содержания токоферолов и β-ситостерола в фитокомпозиции. Нами показано, что введение аскорбиновой кислоты в омыляемую смесь в рекомендуемых Международным протоколом концентрациях, не обеспечивает стабильности системы: приводит к частичному окислению токоферолов, каротиноидов и деструкции β-ситостерола, что выражалось в невоспроизводимости результатов по количественному определению. В качестве антиоксиданта, препятствующего разрушению компонентов МСТ, для проведения пробоподготовки нами предложено использовать тимол. Выбор тимола обусловлен тем, что, как показано в работе Venu, S., 2013, тимол способен в паре с аскорбиновой кислотой проявлять свойства сильного восстановителя, регенерируя окисленную аскорбиновую кислоту [9]. В дальнейшем все эксперименты при пробоподготовке проводились в присутствии смеси тимола и аскорбиновой кислоты при их массовом соотношении 2.5:1(25 % концентрации тимола по отношению к фитокомпозиции). На рис. 2 приведены ВЭЖ-хроматограммы токолов в композиции после омыления жировой фракции в течение 30 и 60 минут в присутствии смеси тимола и аскорбиновой кислоты.
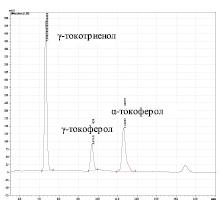
Данные рис. 2 показывают большое влияние времени омыления на состав токолов в композиции. При омылении в течение 30 минут токолы представлены основными тремя компонентами: α-токоферолом (α-Т) (τ = 11.47 мин), γ-токоферолом (γ-Т) (τ = 9.71 мин) и γ-токотриенолом (γ-ТТ) (τ = 7.34 мин). Соотнесение пиков α- и γ-Т было выполнено с использованием их стандартных образцов, а время выхода γ-Т в анализируемых условиях отнесено в соответствии с литературными данными, где анализ проводился в сопоставимых условиях [10]. Показано, что после 30-минутного омыления площадь пика γ-Т в 6 раз выше, чем α-Т, а площадь пика γ-ТТ существенно больше, чем у α-Т (рис. 2, б) . После длительного омыления (60 минут), вероятно, происходит частичный переход γ-Т в γ-ТТ и концентрация γ-Т резко уменьшается, при этом соотношение площади пика γ-Т к α-Т составляет 1:1.5.
Учитывая этот факт, в дальнейшем омыление проводили в течение 30 минут.
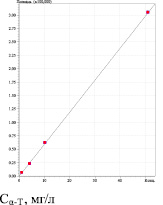
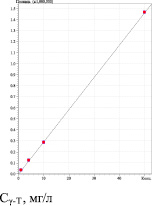
Количественное содержание α- и γ-Т в фитокомпозиции, выполняли с использованием калибровочного графика по стандартам α- и γ-Т (рис. 3). Рассчитанная концентрация α- и γ-Т равна 7.50 мг % и 5.77 мг %, соответственно.
Определение линейности проводили на 4 уровнях концентраций от ожидаемого содержания α- и γ – Т в фитокомпозиции, аналогично определению каротиноидов (рис. 3). Уравнения линейной регрессии и значения коэффициентов корреляции характеризуют приемлемость данной методики по показателю линейности.
Методика соответствует критерию сходимости по величинеRSD, %, равному 1.68 % для α-Т и 3.84 % для γ-Т (табл. 3).
|
а) |
б) |
|
Y = aX + b, где a = 5969.58, b = 0.0, R2 = 0.9999506, r = 0.9999753 |
Y = aX + b, где a = 29267.57, b = 0.0, R2 = 0.9999097, r = 0.9999548 |
|
Рис. 3. Калибровочные графики зависимости площади пика токолов от концентрации по хроматограммам образцов фитокомпозиции после гидролиза; внешними стандартами выступали СО токолов а) α-Т; б) γ-Т |
|
Таблица 3
Определение сходимости методики количественного определения токоферолов в фитокомпозиции на примере модельных смесей
|
Показатели |
Повторность |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
Сα-Т, мг % |
4.5 |
4.7 |
4.6 |
7.3 |
7.6 |
7.5 |
12.3 |
12.5 |
12.4 |
|
Сγ-Т, мг % |
2.9 |
2.7 |
3.1 |
5.8 |
5.9 |
5.6 |
11.3 |
11.7 |
11.5 |
|
Хср α-Т, мг % |
4.60 |
7.48 |
12.4 |
||||||
|
Хср γ-Т, мг % |
2.90 |
5.77 |
11.5 |
||||||
|
RSDα-Т, % |
2.17 |
2.05 |
0.81 |
||||||
|
RSDγ-Т, % |
6.9 |
2.88 |
1.73 |
||||||
Таблица 4
Результаты установления правильности методики количественного определения α-токоферола в фитокомпозиции методом добавок
|
Сисх, мг % |
Добавлено СО, мг % |
Найдено, мг % |
Выход (Открываемость) α-Т, % |
Выход (Открываемость) γ-Т, % |
|||
|
α-Т |
γ-Т |
α-Т |
γ-Т |
α-Т |
γ-Т |
||
|
4.5 |
2.9 |
10 |
14.2 |
12.7 |
97.93 |
98.45 |
|
|
4.5 |
2.9 |
10 |
14.3 |
12.6 |
98.64 |
97.67 |
|
|
4.5 |
2.9 |
10 |
14.3 |
12.9 |
98.64 |
100.0 |
|
|
7.5 |
5.8 |
20 |
27.3 |
25.5 |
99.30 |
98.84 |
|
|
7.5 |
5.8 |
20 |
26.4 |
25.3 |
96.00 |
98.06 |
|
|
7.5 |
5.8 |
20 |
27.2 |
25.9 |
98.91 |
100.39 |
|
|
12.5 |
11.6 |
30 |
42.3 |
41.4 |
99.53 |
99.52 |
|
|
12.5 |
11.6 |
30 |
42.6 |
41.1 |
100.24 |
98.80 |
|
|
12.5 |
11.6 |
30 |
42.3 |
41.8 |
99.53 |
100.48 |
|
a) б)
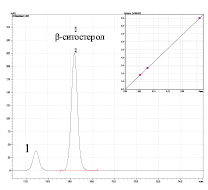
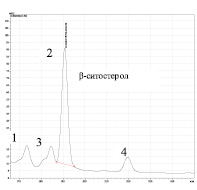
Рис. 4. ВЭЖ-хроматограмма: a) 2 – β-ситостерол; на врезке представлена калибровочная зависимость А = f (Сβ-ст.); 1 – примесь брассикастерола; б) МСТ; 1 – примесь брассикастерола; 2 – β-ситостерол; 3 – кампестерол, 4 – β-D-β-глюкопиранозидная форма ситостерола
Правильность методики устанавливали методом добавок «введено-найдено» путем измерения количественного содержания α- и γ- токоферолов в растворах при добавлении определенного количества стандартов к исследуемому раствору. Отношение количества введенного токола к найденному (Хср) в % соответствовало 98.75 % (α-Т) и 99.13 % (γ-Т), что характеризует разработанную методику как правильную (табл. 4).
На практике были определены пределы обнаружения, как соотношение сигнал/шум, равное 3/2, и предел количественного определения, как соотношение сигнал/шум 10/1.
Методика имеет предел обнаружения равный 0.0015 ± 0.0002 г/мл, предел количественного определения равный 0.010 ± 0.002 г/мл.
Для анализа β-ситостерола в фитокомпозициина основе МСТ был предложен другой режим ОФ-ВЭЖХ-анализа. Выбор режима проводился с учетом подбора элюента, температуры и длины волны детектирования, используя стандарт β-ситостерола и наличия основных минорных компонентов МСТ – кампестерола и стигмастерола.
В качестве элюента была выбрана смесь растворителей – ацетонитрил: спирт этиловый 96 % (85:15), температура колонки – 40 °С, длина волны 210 нм.
На рис. 4 приведена типичная ВЭЖ-хроматограмма композиции после пробоподготовки.
Показано, что количественное содержание β-ситостерола в фитокомпозиции, определенное по калибровочному графику стандарта β-ситостерола равно 150 ± 10 мг %. Известно, что в большинстве пищевых растительных маслах относительный процент содержания β-ситостерола лежит в интервале 50-70 % от общего количества фитостеролов, что соответствует концентрации β-ситостерола от 100 до 400 мкг %.
Линейность определена при 3 концентрациях β-ситостерола. Уравнение линейной регрессии имеет вид: y = 3449375х.Значение коэффициента корреляции составило 0.999.
Сходимость методики оценивали по величине относительного стандартного отклонения RSD %, которое составляло 3.56 %. Правильность методики устанавливали путем измерения количественного содержания β-ситостерола в растворах, полученных путем добавления определенного количества стандарта к исследуемому раствору. Хср находился в пределах от 95,5 до 101,4 %, его средняя величина составила 97,65 %. Таким образом, методика определения β-ситостерола удовлетворяет требованиям по линейности, сходимости, правильности.
На практике были определены пределы обнаружения, как соотношение сигнал/шум, равное 3/2, и предел количественного определения, как соотношение сигнал/шум 10/1.
Методика имеет предел обнаружения равный 0.0075 ± 0.0002 г/мл, предел количественного определения равный 0.050 ± 0.003 г/мл.
Определение бетулина в фитокомпозиции. В качестве элюента была выбрана смесь растворителей – ацетонитрил: вода (90:10), температура колонки – 40 °С, длина волны 210 нм.
На рис. 5 приведена типичная ВЭЖ-хроматограмма бетулина.
Показано, что количественное содержание бетулина в исследуемой фитокомпозиции, определенное по калибровочному графику стандарта бетулина, равно 2.13 ± 0.32 г/100 г
Линейность определена при 5 концентрациях бетулина. Уравнение линейной регрессии имеет вид: y = 6867462х. Значение коэффициента корреляции составило 0.9993. Сходимость методики оценивали величине RSD %, которая составляла 2.8 %.Правильность методики устанавливали путем измерения количественного содержания бетулина в растворах, полученных путем добавления определенного количества стандарта к исследуемому раствору. Хср находилось в пределах от 96.15 до 101.42 %, его средняя величина составила 98.31 %.
На практике были определены пределы обнаружения, как соотношение сигнал/шум, равное 3/2, и предел количественного определения, как соотношение сигнал/шум 10/1.
Методика имеет предел обнаружения равный 0.0075 ± 0.0017 г/мл, предел количественного определения равный 0.0500 ± 0.0011 г/мл.
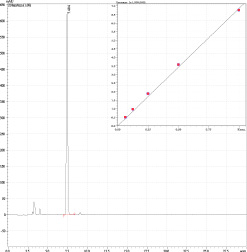
Рис. 5. ВЭЖ-хроматограмма бетулина. На врезке представлена калибровочная зависимость А = f (Сбетулина.) – Y = aX + b, где a = 6867462, b = 0.0, R2 = 0.9992550, r = 0.9996274
Выводы
Разработаны и валидированы методики количественного определения бетулина и каротиноидов, токоферолов и β-ситостерола в фитокомпозиции бетулина и тимола в масле семян тыквы. Методики ВЭЖХ-анализа токоферолов, β-ситостерола и бетулина удовлетворяют требованиям по правильности, линейности, сходимости, робастности и характеризуются пределом обнаружения (равном 0.15 ± 0.01 мг/л для α и γ-токоферолов; 0.0075 ± 0.0002 мг/мл для β-ситостерола), пределом количественного определения (равном 1.00 ± 0.02 мг/л для α и γ-токоферолов; 0.050 ± 0.003 мг/мл для β-ситостерола). Пробоподготовка предполагает омыление 60 % водным раствором КОН в присутствии аскорбиновой кислоты и тимола, взятого в 2,5-кратном избытке по отношению к аскорбиновой кислоте. Методика количественного определения суммарного содержания каротиноидов с использованием спектрофотометрии предполагает первичную очистку гексанового экстракта фитокомпозиции от сопутствующих компонентов с помощью адсорбционной колонки, заполненной оксидом магния. Методика характеризуется правильностью, линейностью и сходимостью.