Введение
Еще в прошлом столетии определенное распространение получили представления об исключительно важной роли бактерий в формировании фосфатов кальция. Однако многочисленные литературные данные о минерализации бактерий базируются в основном на геологическом и экспериментальном материале, полученном при изучении природных фосфоритов [5, 6]. При этом основным аргументом доказательства бактериальной деятельности в минерализационном процессе является морфология частиц. Внедрение электронной микроскопии в практику исследований привело к многократному увеличению таких сообщений и часто сопровождалось предположениями о бактериальной природе фосфоритов [3]. Тем не менее, более детальное изучение с использованием просвечивающей электронной микроскопии высокого разрешения позволило нам установить, что они имеют совсем иную природу [9]. Следует отметить, что в медицинской литературе рассматривается лишь опосредованная роль бактерий в формировании кальций фосфатных образований на клапанах сердца, более того, некоторыми исследователями исходная минерализация клапанов рассматривается в качестве «мишени» для последующей микробной адгезии [2]. Особенный тропизм бактерий к минеральным образованиям организма человека, послужил поводом для создания костнопластических материалов с антибактериальными свойствами [1]. Настоящая работа посвящена изучению минерализации непосредственно кокковых бактерий на клапанах сердца на примере Staphylococcus aureus часто инфицирующих организм человека при септических состояниях и транзиторных бактериемиях. Для этого были проведены структурно-химические исследования кальцинозных образований на клапанах сердца и их биопротезах. Также проведены модельные эксперименты, объясняющие высокую сорбционную способность гидроксилапатита по отношению к бактериям. На основании этих экспериментальных данных и фактического материала по минерализованным сердечным клапанам и их биопротезам сделан вывод о возможности минерализации бактерий в плазме крови.
Цель исследования
Оценить участие бактерий в формировании фосфатов кальция при минерализации клапанов сердца и их протезов и в условиях моделирования ионного состава плазмы, а так же сорбционные свойства фосфатов кальция минерализованных клапанов сердца.
Материалы и методы исследования
Локальные методы структурного и химического анализа были использованы в работе: просвечивающая электронная микроскопия с высоким разрешением (ЭМВР), электронная дифракция, сканирующая электронная микроскопия (SEM) и рентгеновский спектральный микроанализ с энергетической дисперсией (ЕDХ). Применялись следующие инструменты: просвечивающий электронный микроскоп JEM2010 (ускоряющее напряжение 200 кВ, разрешение 1,4 Å), оснащенный ЕDХ ЕDАХ (разрешение 130eV) и сканирующий электронный микроскоп LЕО1430VР, оснащенный ЕDХ ОXFORD (разрешение 128eV) с программным обеспечением для элементного анализа INKA ENERGY. Обработка полученных электронно-микроскопических изображений проводилась с использованием программы Gatan DigitalMicrograph.
Объекты минерализации: В настоящей работе мы использовали интраоперационный материал: минерализованные аортальные и митральные клапаны сердца и их биопротезы (pig) септического генеза. Природные клапана сердца были взяты от пациентов приобретенными пороками, минерализованные биопротезы при повторных операциях, направленных на замену клапана. Предварительно проводился макроскопический и гистологический анализ всех исследуемых клапанов сердца.
В настоящей работе было использовано около 50 образцов клапанов сердца и их биопротезов. По данным SEM кальцинозные включения в природных клапанах и биопротезах содержат округлые частицы величиной 1-5 мкм. Однако после детального просмотра в SEM были отобраны 5 образцов, в которых значительная часть частиц сферической формы имели размер близкий к величине кокковых бактерий Staphylococcus aureus инфицирующих в организме человека (Рис. 1).

Рис. 1. Частицы фосфата кальция похожие на бактерий на диатомовой водоросли из современных океанических фосфоритов
Минеральная часть этих включений была разделена на две части. Одна часть исследовалась на просвечивающем электронном микроскопе. Другая была помещена в эпоксидную смолу и отполирована для получения cross-section этих частиц. В исследовании особенностей минерализации бактериальных культур был использован штамм Staphylococcus aureus из коллекции Института имени Гаммалеи Российской Академии Медицинских наук.
Условия эксперимента сорбции бактерий гидроксилапатитом: В эксперименте по сорбции бактерий использовался гидроксилапатит, который предварительно был выделен из кальцификатов сердечных клапанов, подвергшихся массивной минерализации. Процедура отделения гидроксилапатита от органической части клапанов включала следующие действия. Первоначально кальцификаты были механически отделены от органической части клапанов и помещены в пробирки с дистиллированной водой. Затем производилась их диспергация на ультразвуковом диспергаторе УЗДН-2 с частотой 22 кГц в течение 10 минут. После кратковременного осаждения крупных частиц из раствора оставшаяся часть раствора сливалась в пробирки. После этого осадок мелкодисперсных частиц HAP был отожжен в муфельной печи на воздухе при температуре 600ºС в течение 1 часа.
На нейлоновой вате были сформированы колонки для сорбции в инсулиновых шприцах, где в качестве сорбента использовался гидроксилапатит и в качестве контроля углерод – минеральный сорбент СУМС-1, использующийся в настоящее время в клинической практике. Одинаковые объемные соотношения гидроксилапатита и сорбента были использованы в первой серии эксперимента и в соотношении 1:2 во второй серии. Бактериальные культуры в разведении 1 × 105 бактериальных тел пропускались через эти колонки. Это количество бактерий соответствует пику определяемых бактериальных тел в гемокультуре венозной крови при транзиторной бактериемии. Бактериологический контроль проводился на стандартных средах.
Условия эксперимента минерализации бактерий Staphylococcus aureus
В экспериментальных культурах формировалась среда с исходным уровнем ионов Са2+ = 1.33мМ, Р5+ = 1.5мМ, Mg2+ = 0.8мМ и Na+Cl- = 0.15М при температуре 37ºС с экспозицией 4 суток. В чашку Петри с раствором помещалась микробная культура Staphylococcus aureus на твердом агаре. Водный раствор с такой концентрацией ионов Са, Р, Mg, NaCl и рН =7.4 был получен нами при моделировании ионного состава крови здорового взрослого человека. В этих условиях не происходит образования фосфатов кальция в даже по истечении нескольких лет о чем можно судить по отсутствию в водном растворе какого-либо осадка. Контролем служила аналогичная микробная культура, но выращенная с использованием стандартной среды. После экспозиции выполнялась подготовка для наблюдения в SEM, которая включала обезвоживание, сушку, монтирование и покрытие углеродом.
Результат
Наблюдение в SEM минерализованных сердечных клапанов показало некоторые особенности бактериальной колонизации абсцессов: их зональный рост и формирование многоуровневых колоний. Кроме того наблюдается формирование ассоциаций из кокковой и палочковой флоры или отдельно только из палочковой и только кокковой флоры.Характерно, что кокковая флора предпочтительно ориентирована на минеральную часть клапанов при зональном и колониальном росте, в то время как палочковая чаще ориентирована на органические составляющие абсцесса. Наблюдения также показали, что эндотелиальный слой в участках абсцесса не является постоянным. В отдельных участках абцессов заметно выражен полиморфизм эндотелия, часть которого имеет тенденцию к набуханию. В некоторых случаях можно было наблюдать результат заселения минеральной составляющей форменными элементами (эритроциты) и белками плазмы крови, что свидетельствует о прижизненном контакте минеральной составляющей с кровью.
Исследование морфологических особенностей минеральной части клапанов сердца показало, что включения HAP в их периферийных областях представлены округлыми частицами по величине аналогичными или превышающими размер инфицирующих в организме кокковых бактерий (1-5 микрон). В отобранных для исследования минерализованных клапанах сердца их размер был близок к размеру естественных бактерий (Рис.2а). Наблюдения в SEM поперечного сечения кальций фосфатных включений в режиме обратно рассеянных электронов показали, что некоторые округлые частицы в центральной части представлены органическим компонентом (Fig.2б). На рис.2б. видны контуры минерализованных с поверхности бактерий Золотистого стафилококка отличающиеся по размеру.


Рис. 2. Электронно-микроскопические изображения минерализованных бактерий Staphylococcus aureus на биологическом протезе сердечного клапана: а – SEM морфология поверхности бактерий во вторичных электронах; б – cross-section кальцификата аналогичного области – а, SEM снимок в обратно-рассеянных электронах
Такое различие получается как результат полировки округлых частиц, расположенных на разных уровнях кальцификата. На рис.1b также можно видеть, что многие бактерии минерализованы и во внутренней центральной части. Здесь остается сомнение, что это является результатом контаминации при полировке образца. Однако в таком случае должна наблюдаться и контаминация полировочной пастой, что не подтверждается EDX анализом таких участков.
Согласно данным ПЭМ, образцы кальцификатов биопротезов представлены в основном HAP нанокристаллами игольчатой формы около 150 нм длиной и 5 нм шириной (рис.3). Несколько слоев одинаковых по размеру нанокристаллов HAP игольчатой формы расположены на волокнах коллагена и ориентированы вдоль волокон.


Рис. 3. TEM изображение кальцификата на биопротезе сердечного клапана. Нанокристаллы гидроксилапатита на волокнах коллагена (слева) и предположительно во внутренней области бактериальной клетки (справа)
Другая неорганическая часть кальцификата состоит из совокупности произвольно ориентированных HAP нанокристаллов аналогичных по структуре и морфологии с кристаллами первой серии. Эти частицы достигают от 300 до 500 нм даже после ультразвукового диспергирования используемого при подготовке пробы для исследования ПЭМ. Игольчатая форма HAP нанокристаллов типична для кальцификатов на сердечных клапанах . Их упорядоченное расположение на волокнах коллагена отличается от беспорядочного расположения в остальной части кальцификата отобранного для исследования методом TEM. Кальций фосфатная минерализация активированная бактериями Staphylococcus aureus происходит преимущественно на внешней оболочке бактерий так и внутри бактерий. При этом не замечено выделенных направлений для нанокристаллов гидроксилапатита по отношению к поверхности бактерий в сравнении с волокнами коллагена.
Проверка сорбционной способности гидроксилапатита, выделенного из минерализованных сердечных клапанов, дала следующие результаты. В первой серии эксперимента после 2-х кратного пропускания через СУМС-1 было получено: 3.75·104 бактериальных тел после первого пропускания и 1.23·104 после второго. Во второй серии при аналогичных условиях с использованием сорбента получены близкие результаты. При использовании в качестве сорбента гидроксилапатита, селектированного из минерализованных сердечных клапанов, получено почти полное поглощение бактериальной культуры, хотя во второй серии объемное соотношение HAP и специализированного сорбента было в два раза меньше.
Результат эксперимента по минерализации бактерий, следуя медицинской терминологии, также дал положительный результат. В эксперименте с бактериальной культурой Staphylococcus aureus было установлено, что уже по истечении четырех суток некоторые бактерии могут формировать кальциевый фосфат на поверхности отдельных бактерий (Рис. 4). Отношение кальция к фосфору по данным EDX наиболее соответствует гидроксилапатиту.
Обсуждение
По содержанию кальция, фосфора, натрия и магния кровь человека и позвоночных животных может служить в некотором приближении аналогом морской воды. Поэтому традиционно новые результаты минералогии, полученные при решении проблем образования природных фосфоритов, используются в медицине. Также экспериментальные данные, моделирующие образование костного апатита и патологических фосфатов кальция в организме человека, служат экспериментальной базой для разработки моделей образования минералов в морских условиях [7]. Деградация органического материала бактериальными ферментами обеспечивает главный источник растворенного неорганического фосфора в водных толщах и артезианских флюидах, где он расходуется как предпочтительное питательное вещество микроорганизмами и растениями и может преципитировать как аутогеничный апатит [3]. Однако наше исследование структуры похожих на бактерии частиц гидроксилапатита из современных фосфоритов с использованием электронной микроскопии высокого разрешения не подтвердило их бактериальную природу [9]. В связи с этим следует отметить, что морфологические аналогии являются необходимым, но недостаточным признаком доказательства минерализации бактерий. Поэтому наше исследование влияния бактерий на процесс минерализации сердечных клапанов имеет комплексный характер и основывается также на данных клинических и гистологических исследований.
Инфекционный эндокардит, поражающий естественные клапаны сердца или их биопротезы, представляет сегодня одну из наиболее сложных и острых проблем хирургии приобретенных пороков сердца. Замечено что фактор риска при инфекционном эндокардите возрастает десятикратно [4]. Патогенетическая связь кальцификации и бактериального эндокардита отмечается и авторами работы [2].
Многочисленные наблюдения абсцессов сердечных клапанов связанных с минерализацией дают нам основание предположить, что развитие абсцессов клапанов сердца на фоне минерализации является закономерным процессом поздних стадий минерализации [2б]. Наши экспериментальные данные служат подтверждением такого вывода.
Характерно, что кальций фосфатная минерализация естественных сердечных клапанов происходит внутри ткани клапана. В этих условиях гидроксилапатит не может взаимодействовать с бактериями в связи с их большим размером. При этом бактерии не могут проникать и взаимодействовать с HAP внутри ткани клапана. Вероятно, для естественных минерализованных сердечных клапанов условия контакта с бактериями, находящимися в крови, могут возникнуть на поздних стадиях минерализации. Тогда бактерии Золотистого стафилококка могут контактировать с кальцификатом (повреждение эндотелия, деградация ткани или прямой выход в кровоток). Доказательством наличия контакта с кровотоком служат эритроциты, наблюдаемые в этих образцах. Экспериментальные результаты показывают аномально высокую сорбционную способность нанокристаллического гидроксилапатита, образованного при кальцификации сердечных клапанов. Сорбция бактерий из кровотока на агрегат нанокристаллов гидроксилапатита приводит к многократному увеличению их концентрации на клапане и соответственно увеличению их инфекционной активности.
.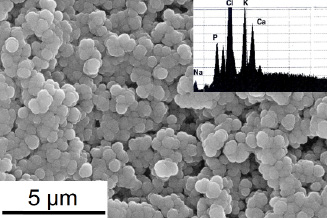
Рис. 4. Колония Staphylococcus aureus на твердом агаре после 4 дней экспозиции в водном растворе с исходным уровнем ионов Са2+ = 1.33мМ, Р5+ = 1.5мМ, Mg2+ = 0.8мМ и Na+Cl- = 0.15М. На врезке EDX спектр единичной минерализованной бактерии
Биологические протезы сердечных клапанов еще в большей степени подвержены фактору риска повышения инфекционной активности бактерий при сопутствующей кальций фосфатной минерализации, потому что защитные функции для них менее выражены (отсутствие эндотелия и др.) в сравнении с естественными клапанами сердца.
Эксперимент показал, что бактерии Золотистого стафилококка способны к собственной минерализации в плазме крови, когда содержание ионизированного кальция, фосфора и магния соответствуют их концентрации в крови здорового взрослого человека. Кроме того увеличение концентрации ионизированного кальция и/или фосфора в крови человека в условиях некоторых патологий приведет к увеличению произведения растворимостей, которое иногда характеризуют произведением концентраций Ca×P. Это в свою очередь будет способствовать увеличению количества патологического гидроксилапатита в крови пациентов.
Все практикующие врачи знают о вреде бактерий Staphylococcus aureus на организм человека. Однако способность бактерий активировать собственную кальций фосфатную минерализацию в условиях плазмы крови не была оценена до настоящего времени.
Заключение
Развитие абсцессов клапанов сердца и их биопротезов на фоне минерализации является закономерным процессом поздних стадий минерализации. Установлена способность Staphylococcus aureus активировать кальций фосфатную минерализацию в организме человека, что увеличивает факторы риска патогенеза болезней кровеносных сосудов и сердца, особенно осложненных кальцификацией.

