Иодпроизводные антрахинона обычно получают нуклеофильным замещением на атом иода диазогруппы или других атомов галогенов [1, с. 189, 236]. О прямом иодировании ядра антрахинона имеется мало данных. Сообщено о получении 1,5- и 1,8-дииодантрахинонов путем обработки антрахинона иодом в смеси серной и азотной кислот [2]. Двумя группами исследователей изучено прямое иодирование 1- и 2-аминоантрахинонов и показано, что эти соединения иодируются в орто- и пара-положения к аминогруппе при действии иода в уксусной кислоте в присутствии ацетата серебра [3] или при действии иода и иодноватой кислоты в присутствии серной кислоты [4] С целью развития способов прямого иодирования ядра антрахинона нами изучено действие на аминоантрахиноны иода в олеуме. Ранее эта реакция не исследовалась. Как известно [5, с. 9, 13], 1-аминоантрахинон, а также 1,4-диаминоантрахинон при хлорировании в олеуме дают 5,8-дихлор-1-амино- и 5,8-дихлор-1,4-диаминоантрахиноны соответственно, т.е. хлорируются в альфа-положения незамещенного кольца. Изменение ориентации электрофильного замещения при галогенировании в олеуме обусловлено тем, что первичная аминогруппа в результате взаимодействия с компонентами олеума (триоксидом серы, пиросерной кислотой) утрачивает свойства электронодонорного заместителя. В частности, 1-аминоантрахинон протонируется по аминогруппе с превращением ее в электроноакцепторную аммонийную группу, а 1,4-диаминоантрахинон превращается в циклический бис-сульфимидоэфир (1), который является производным 1,4-антрахинона и хлорируется в положения 5 и 8, образуя соединение 2 [5, 6].
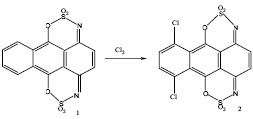
Можно было ожидать, что иодирование аминоантрахинонов в олеуме будет происходить аналогично хлорированию. Однако результаты проведенного нами исследования оказались существенно отличающимися от ожидаемых. При добавлении к раствору 1-аминоантрахинона (3) в 63%-ном олеуме эквимолярного количества иода и последующем выдерживании реакционной смеси при комнатной температуре наблюдалось (методом ТСХ на пластинках Силуфол) постепенное исчезновение исходного амина и образование более глубоко окрашенного соединения в качестве основного продукта реакции. Через 4 часа исходный амин практически полностью расходовался. После того, как продукт реакции (4) был выделен и проведено изучение его строения, выяснилось, что он содержит первичную аминогруппу, гидроксильную группу и не содержит атомов иода. При диазотировании и замещении диазониевой группы на водород из него был получен 1-оксиантрахинон (5), что указывало на вхождение гидроксильной группы в альфа-положение ядра антрахинона. Сравнение соединения 4 с заведомым образцом 1-амино-4-оксиантрахинона выявило их идентичность. Таким образом, в результате взаимодействия 1-аминоантрахинона с иодом в крепком олеуме произошло не иодирование, а гидроксилирование ядра антрахинона в пара-положение к аминогруппе. Выход соединения 4 составил 70%.
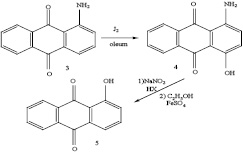
Гидроксилироване окси- и аминоантрахинонов действием концентрированного олеума известно как реакция Бона-Шмидта [1, с. 228; 7-10]. Установлено, что 1-аминоантрахинон гидроксилируется в положение 4 при выдерживании в 80%-ном олеуме в течение нескольких суток при температуре 25-400С [9]. Катализаторами реакции Бона-Шмидта являются ртуть и селен, примеси которых содержатся в техническом олеуме; в химически чистом растворе триоксида серы в серной кислоте реакция не идет [1, с.229]. Для ускорения реакции гидроксилирования используют добавки таких окислителей, как диоксид марганца, диоксид свинца, персульфаты, нитрит натрия. В присутствии добавок галогенов процесс гидроксилирования сопровождается процессом галогенирования. Так, при обработке 1,4-диамино-антрахинона в 20%-ном олеуме хлором или бромом в присутствии иода образуются соответствующие 1,4-диамино-5,8-дигидрокси-6,7-дигалогеноантрахиноны [1, с. 229].
О роли добавок иода в реакции Бона-Шмидта сведений нет. Как найдено нами, реакция доходит до конца (за 4 часа при комнатной температуре) только при использовании не менее, чем 0.5 моля иода на 1 моль 1-аминоантрахинона. Если взять иод в количестве 0.2 или 0.1 моля на 1 моль 1-аминоантрахинона, то даже при увеличении времени реакции до 8 часов в смеси остается не вступивший в реакцию 1-аминоантрахинон. В соответствии с представлениями о свободнорадикальном механизме реакции Бона-Шмидта с участием радикала HSO4·•, возникающим при гомолизе пиросерной кислоты [9, с. 108] логичным является предположение, что иод, действуя как донор электронов, способствует процессу образования радикальных частиц из пиросерной кислоты:
2 H2S2O4 + J2 → 2 HSO4• + 2 HSO3ˉ + 2J+
Приведенная схема, согласно которой одна молекула иода участвует в генерировании двух радикалов HSO4•, объясняет наблюдаемую стехиометрию реакции гидроксилирования 1-аминоантрахинона.
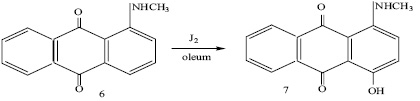
1-Метиламиноантрахинон (6) при обработке иодом в олеуме реагирует аналогично 1-амино-антрахинону: при выдерживании его вместе с эквимолярным количеством иода в 63%-ном олеуме (2 часа при комнатной температуре) получен 1-метиламино-4-оксиантрахинон (7) с выходом 61%. Строение продукта реакции доказано элементным анализом, ИК и ПМР спектрами. В спектре ПМР (в дейтерохлороформе) наблюдаются сигналы при 3.55 м.д. (дублет, J = 7 Гц), 7.07 м.д (широкий), 7.65 – 8.37 м.д. (А2В2-система), 10.03 м.д.(мультиплет), 13.81 м.д. (синглет), которые отвечают протонам группы СН3, двум протонам замещенного бокового кольца, протонам незамещенного бокового кольца, протону вторичной аминогруппы, протону гидроксильной группы соответственно.
1,5-Диаминоантрахинон более устойчив, чем 1-аминоантрахинон, к действию иода в олеуме: в 63%-ном олеуме в присутствии иода (2 моля на 1 моль амина) его полное превращене достигается лишь через 70 часов при комнатной температуре. При этом получается смесь нескольких продуктов реакции, из которых нам удалось выделить и идентифицировать 1,5-диамино-4,8-диоксиантрахинон (выход 14%). Среди неидентифицированных продуктов реакции преобладают глубоко окрашенные, раствормые в воде соединения, являющиеся, вероятно, сульфокислотами 1,5-диамино-4,8-диоксиантрахинона.
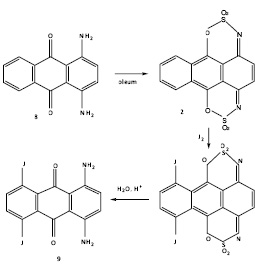
Как указывалось выше, 1,4-диаминоантрахинон в крепком олеуме образует циклический бис-сульфимидоэфир (1), который представляет собой производное 1,4-антрахинона. Это обстоятельство существенно изменяет реакционную способность бокового кольца, несущего аминогруппы, в частности, дезактивирует его к электрофильному замещению. По аналогии с реакцией хлорирования следовало ожидать, что 1,4-диаминоантрахинон будет реагировать с иодом за счет незамещенного бокового кольца. Действительно, при нагревании (950С, 5 час) в 63%-ном олеуме эквимолярных количеств 1,4-диаминоантрахинона (8) и иода с последующим выливанием реакционной смеси на лед, гидролизом сульфимидных групп и хроматографированием продуктов реакции на окиси алюминия нами был получен с выходом 56% 5,8-дииод-1,4-диаминоантрахи-нон (9). Строение последнего установлено на основании данных элементного анализа, ИК. УФ и ПМР спектров.
Хинизарин (1,4-диоксиантрахинон) при нагревании с борной кислотой в уксусном ангидриде или олеуме образует хелатные комплексы, напоминающее по своей структуре и реакционной способности бис-сульфимидоэфир 2, получаемый из 1,4-диамино-антрахинона [1, с.93]. Борацетаты выделены и изучены в кристаллическом состоянии, борсульфаты получают и используют без выделения в реакциях, проводимых в олеуме..Известно, что хинизарин в виде комплекса с борной кислотой хлорируется в олеуме в положения 5 и 8 [1, с. 184]. Следовало ожидать аналогичного поведения боросульфатного комплекса хинизарина в реакции иодирования. Как нами установлено, при обработке хинизарина иодом в смеси 63%-ного олеума и борной кислоты (мольное соотношение хинизарин : иод : борная кислота равно 1 : 2 : 2.3) при температуре 90-950С имеет место прямое иодирование хинизарина в боковое кольцо, не содержащее гидроксильных групп, но, неожиданно, в положение 6. Продуктом реакции является 6-иодхинизарин (10), получающийся с выходом 87%. Строение соединения 10 доказано данными элементного анализа, ИК и ПМР спектров. В ИК спектре (в KBr) наблюдаются полосы поглощения гидроксильных (3440 см-1 широкая полоса) и карбонильных (1630 см-1) групп, связанных внутримолекулярной водородной связью. Отсутствуют полосы в области 700-750 см-1, которые характерны для бокового кольца, имеющего 4 соседних атома водорода. Спектр ПМР (в 100%-ной серной кислоте, внешний стандарт ТМС) содержит 4 сигнала протонов ядра (δ, м.д.): 7.50 с, 7.93 д , J= 9.6 Гц, 8.29 д, J= 9.6 Гц, 8.60 с, которые отвечают соответственно двум протонам в положениях 2 и 3, протону в положении 7, протону в положении 8 и протону в положении 5.
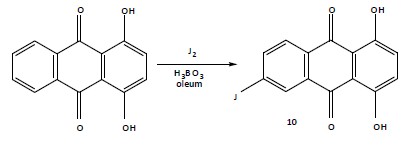
Точная структура боросульфатного комплекса хинизарина (БКХ) неизвестна, так как комплекс получают и перерабатывают далее, не выделяя из реакцтонной смеси. Поэтому различная ориентация электрофильного замешения при иодировании бис-сульфоимидоэфира 1,4-диаминоантрахинона (2), с одной стороны, и БКХ, с другой стороны, может быть объяснена лишь предположительно. По литературным данным [1, с. 182, 174] БКХ ведет себя аномально в реакциях нитрования и сульфирования: он не нитруется в отличие от соединения 2, которое дает 5-нитропроизводное, при сульфировании в присутствии соли ртути, катализирующей замещение в альфа-положении антрахинонового ядра, образует 6-сульфокислоту. Можно предположить, что в БКХ существенную роль играет стерическое экранирование альфа-положений боросульфатными группами –B(OSO3H)2. Поэтому объемные электрофильные реагенты (SO3, J3+) преимущественно атакуют положения 6 или 7.
6-Иодхинизарин (10) представляет интерес как промежуточный продукт для синтеза антрахиноновых красителей. На его основе могут быть получены труднодоступные 6-ариламино-1,4-диокси- и 1,4,6-триариламиноантрахиноновые красители, а также иодсодержащие 1,4-диариламиноантрахиноновые красители, которые благодаря специфическому ауксохромному влиянию атома иода будут обладать новыми колористическими оттенками. С целью получения красителей последнего типа нами проведена конденсация 6-иодхинизарина с рядом ароматических аминов по известной методике, отличающейся тем, что конденсацию ведут в присутствии цинка, соляной кислоты и борной кислоты. Данная методика оказалась пригодной в случае использования стерически незатрудненных ариламинов ( о- и п-толуидинов, п-н-бутиламина, п-амино-дифенилоксида). Однако при использовании стерически затрудненного ароматического амина (мезидина) выход целевого соединения был низким. Более гладко происходила конденсация мезидина с лейко-6-иодхинизарином, приготовленным заранее путем восстановления 6-иодхинизарина дитионитом натрия в щелочном растворе. Наиболее высокий выход 6-иод-1,4-димезидиноантрахинона достигнут в присутствии добавок борной и салициловой кислот. Смесь салициловой и борной кислот в мольном соотношении 1 : 7 особенно эффективна. Строение полученных 6-иод-1,4-диариламиноантрахинонов подтверждено данными элементного анализа, ИК и УФ спектров. В электронных спектрах поглощения этих соединений наблюдается двойная полоса в области 610-680 нм, характерная для 1,4-диаминопроизводных антрахинона [11].
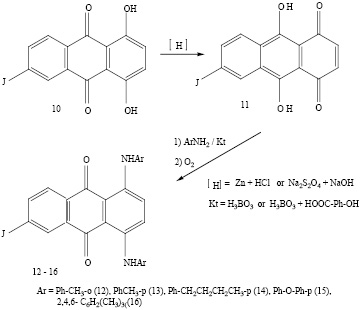
При сульфировании, которое происходит за счет ариламиногрупп, 6-иод-1,4-диариламиноантрахиноны превращаются в кислотные красители, являющиеся иодпроизводными известных кислотных антрахиноновых красителей. Так, путем сульфирования 5%-ным олеумом 6-иод-1,4-ди (п-толуидино)антрахинона получен кислотный краситель, являющийся иодированным аналогом известного красителя «хромовый зеленый антрахиноновый». Полученный краситель окрашивает шерсть в более чистый зеленый цвет, чем известный краситель.

