При бесплодии неясного генеза важным фактором может служить уменьшение овариального запаса, когда никакое другое очевидное объяснение происхождения не найдено [7] Методы, основанные на определении уровня различных пептидов, вырабатываемых в яичнике (ингибин-А и ингибин-В, активин-А, антимюллеровый гормон), обладают высокой точностью определения овариального резерва. Прикладные методы оценки овариального резерва, применяемые для установления риска развития бесплодия, не имеют до настоящего времени объяснения причин этого явления и роли в его патогенезе ингибинов, в частности, ингибина-А.В настоящее время ряд исследователей [14] пришли к выводу, что даже наличие достаточных уровней ингибина-А в крови не гарантирует успех при лечении бесплодия. Это связано, вероятно, с наличием у пациентов биохимических факторов воспаления (цитокинов, острофазовых белков), вызывающих снижение биологической активности ингибина-А. Выяснить этот механизм мы и попытались в нашем исследовании. Известно [5], что ингибин-А и активин способны образовывать стабильные комплексы с некоторыми растворимыми белками, и эти комплексы снижают способность ингибина-А взаимодействовать с рецепторным аппаратом. Среди маркеров воспаления один из наиболее распространенных – лактоферрин, который обладает, многократно доказанной способностью к интерполимерным взаимодействиям [2, 13].
Ранее мы исследовали способность ингибина-А образовывать комплексы с лактоферрином [3]. Проведенный анализ возможности образования комплексов Ингибина-А с лактоферрином методами электрофореза в полиакриламидном геле и иммуноэлектрофореза показал образование комплексов ингибин-А-лактоферрин на основании изменения электрофоретической подвижности ЛФ и ингибина-А. Предполагается, что фракции с большей электрофоретической подвижностью содержат преимущественно молекулы ингибина-А (имеющего больший отрицательный заряд), а в более медленной фракции преобладает положительный заряд лактоферрина. В настоящей работе приводятся данные хроматографического исследования комплексов ингибин-лактоферрин и оцениваются возможные механизмы образования этих интерполимерных комплексов.
Материалы и методы исследования
В работе использовали препарат ЛФ, полученный в нашей лаборатории и полученный нами по описанному ранее способу ингибин-А[1] Для выяснения возможности образования межмолекулярных комплексов ингибина-А и ЛФ использованы метод гель-фильтрации на сефадекс G-200 («Pharmacia», Швеция) категории «Fine», а также Toyopearl (Toyo-Soda, Япония). Исходный препарат (объем которого составлял 0,5–1 % от рабочего объема колонки), предварительно смешанный с рабочим буфером (0,1 М натрий-фосфатный буферный раствор рН = 7,3). В объемном соотношении 1:1 и голубым декстраном-2000 (до 0,2 % концентрации), вносили в колонку при помощи пипетки, осторожно наслаивая его на открытый (но не высохший) слой сорбента. Элюция проводилась со скоростью 10 мл/см2*ч. Максимальный гидравлический напор не превышал 1/2. Сбор белковых фракций начинали в тот момент, когда окрашенная голубая зона приближалась к концу колонки. Сбор фракций осуществляли на программируемом коллекторе фракций BioFrac с ультрафиолетовым детектором фракций (BioRad).Идентификацию лактоферрина и ингибина во фракциях осуществляли методом иммунодиффузии. Регенерацию колонки проводили промыванием геля 1 М раствором NaCl и 2-3-мя объемами рабочего буфера.
Ввиду того, что синтетический гель Toyopearl резистентен к давлению, хроматографический процесс проводили при высоком давлении гидравлического столба, что значительно ускоряло процесс разделения белковых фракций. Во всем остальном основные принципы процесса гель-проникающей хроматографии на Toyopearl и на сефадексе G-200 были сходны.
Результаты исследования и их обсуждение
Как видно из рис. 1, смесь лактоферрина и ингибина-А образует три крупных хроматографических пика, причем пик 2 и пик 3 разделяются не полностью. Расчет молекулярной массы белков, содержащихся в пике 1, показал молекулярную массу 275-285 KД. Вершина пика 2 соответствует молекулярной массе 110-115 KД. Молекулярная масса белков, входящих в пик 3, не превышает 45 KД.
Нами проведен иммунохимический анализ фракций, входящих в пик 1, пик 2 и пик 3. пик 1 собирали с 23 по 30 пробирку, пик 2 собирали с 40 по 45 пробирку, пик 3 собирали с 48 по 52 пробирку. Полученные фракции диализовали и концентрировали до исходного объема.
Анализ показал, что пик 1, имеющий молекулярную массу около 280 КД, содержит лактоферрин, а антитела к ингибину-А в этой хроматографической фракции его не выявляют. Но молекулярная масса хроматографической фракции пик 1 более чем в 3 раза превышает молекулярную массу ЛФ, которая по разным данным колеблется от 76 до 80 КД [20]. На рис. 2 представлен иммуноэлектрофоретический анализ полученных фракций.
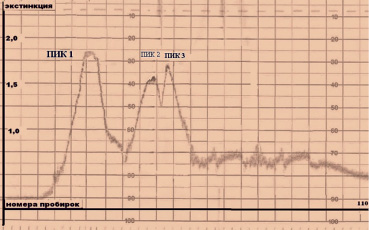
Рис. 1. Гель-фильтрация смеси ингибина-А и лактоферрина № 2–3 через сефадекс G-200. Колонка 1,7х85 см, фракции по 5 мл
В данном случае, можно предположить, что молекулы ингибина-А служат инициаторами процесса олигомеризации ЛФ, а отсутствие иммунохимической реакции на ингибин-А в составе межмолекулярного комплекса ЛФ – ингибин-А может быть результатом преимущественно гидрофобного взаимодействия молекул ЛФ и ингибина-А. При этом более крупная молекула ЛФ сохраняет доступными свои антигенные детерминанты, а молекулы ингибина-А «укрываются» гидрофобными участками ЛФ и теряют возможность взаимодействовать с антителами.
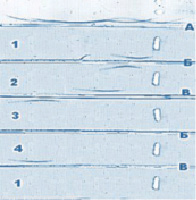
рис. 2. Иммуноэлектрофорез хроматографических фракций смеси ингибина-А и ЛФ. пик 1 (№№ пробирок 23-30); 2. пик 2 (№№ пробирок 40-45); 3. пик 3(№№ пробирок48-52); 4. препарат ингибина-А (контроль) А – антисыворотка к белкам сыворотки крови человека; Б – антисыворотка к ЛФ; В – антисыворотка к ингибину-А
Способность к образованию олигомерных форм ЛФ показана группой исследователей под руководством E.Zelass-Rochard [16]. Было обнаружено, что ЛФ может образовывать димеры и тетрамеры.
По нашим данным белок, входящий в состав пика 1, не может быть тетрамером ЛФ, т.к. молекулярная масса тетрамера не менее 310 КД, а для димера молекулярная масса пика 1 слишком велика. На этом основании мы считаем наиболее вероятным объяснением существование межмолекулярного комплекса из двух молекул ЛФ и нескольких молекул ингибина, связывающих молекулы ЛФ на основе гидрофобного взаимодействия. Этот тип взаимодействия, наряду с электростатическим, рассматривается многими авторами как наиболее вероятный. Эти функции выполняют аминокислотные и, возможно, гликозидные остатки ЛФ.
Кроме того, известно, что во многих биологических жидкостях (например, молоке) ЛФ находится в комплексе с другими белками, включая иммуноглобулины, церуллоплазмин, растворимый фактор CD14, интерлейкин-7 [4, 6]. Эти авторы предполагали, что способность ЛФ к комплексообразованию определяется концентрацией данного белка в среде. Они наблюдали активное образование комплексов ЛФ с иммуноглобулинами и церрулоплазмином при концентрациях ЛФ более 0,1–1 нМ. Интересно, что концентрация ЛФ в крови чаще всего соответствует примерно этой величине и, таким образом, ЛФ в крови может быть смесью свободного ЛФ и его комплексов с другими белками, что отражается на функции этих белков [15].
Мы собрали ингибин-негативные хроматографические фракции, входящие в пик 1 (рис. 1) и провели рехроматографию, но уже в присутствии 0,2 М гепарина, известного наибольшим сродством к лактоферрину и способного вызывать диссоциацию любых межмолекулярных комплексов, содержащих этот белок [8, 11].

Рис. 3. Гель-фильтрация межмолекулярного комплекса ингибина-А и ЛФ через сефадекс G-200 в присутствии 0,2 М гепарина. Колонка 1,7х85 см, фракции по 5 мл
Как видно из рис. 3, в присутствии гепарина белковый комплекс с молекулярной массой 275–285 КД разделяется на два крупных компонента с молекулярной массой пик 1 равной 82 КД и пик 2 равной 44 КД, что соответствует литературным данным о молекулярной массе ЛФ и ингибина-А, соответственно. Учитывая данные иммуноэлектрофоретического анализа хроматографических фракций происходит диссоциация комплекса, и в пике 1 содержится ЛФ, а в пике 2 ингибин-А.
Природа межмолекулярных связей ЛФ до настоящего времени не выяснена. Есть основания полагать, что в организации межмолекулярных комплексов белка участвуют слабые, преимущественно гидрофобные и электростатические взаимодействия аминокислотных и, возможно, гликозидных остатков ЛФ [9, 10]. Полученные нами данные подтверждают это предположение
Полученные нами данные подтверждают предположение, что в организации межмолекулярных комплексов белка участвуют слабые, преимущественно гидрофобные и электростатические взаимодействия. Принимая во внимание небольшой размер мономерной молекулы ЛФ (76–80 КД) и его исключительную полифункциональность, мы предположили, что различные функции белка могут реализоваться на уровне его моно-, ди-, три- и тетрамерных форм, а переход между этими формами может быть под контролем таких лигандов, как ингибин.

