Как известно, Периодический Закон Д.И. Менделеева, наиболее точная современная формулировка которого звучит как «Большинство свойств химических элементов находится в близкой к периодической зависимости от заряда соответствующих им нуклидов (атомных ядер)» не имеет (по крайней мере на сегодняшний день) четкой математической формулы, в рамках которой эти самые свойства были бы количественно связаны с зарядом нуклида. В связи с этим в разное время было предложено весьма значительное количество различных вариантов интерпретации данного закона – т.н. табличные, «лестничные», «спиральные», «пирамидальные» и др. Впрочем, исследовательская мысль и фантазия в этом направлении в основном поработала «вхолостую», ибо сколько-нибудь значительное распространение получили лишь табличные формы. Наиболее ранним из них был табличный вариант, предложенный самим Менделеевым, дальнейшее совершенствование которого уже после его смерти дало т.н. «короткопериодический вариант», описанный, в частности, в [1–3] (рис 1), в котором имеется 8 групп химических элементов и семь т.н. периодов (при этом последний, седьмой, пока что не завершен), имеет, однако, как минимум три недостатка. Во-первых, d-элементы в рамках каждого из тех периодов, где они присутствуют (а именно – начиная с четвертого), располагаются как бы в «два этажа» (рис. 1). Во-вторых, f-элементы (лантаноиды и актиноиды) здесь находятся по существу уже не в самой таблице, а вынесены за ее пределы в виде неких «приложений». В-третьих, при любом из двух возможных (и принятых) вариантов расположения первого из всех химических элементов – водорода (в первой или в седьмой группах) в этой самой таблице остается шесть (!) пустых клеток, и чем их заполнить, непонятно. В связи с этим вскоре после кончины Д.И. Менделеева швейцарский химик А. Вернер предложил несколько иной вариант интерпретации Периодического Закона, получивший название «длиннопериодический вариант», в рамках которого было уже 18 групп химических элементов при тех же семи периодах, в котором первый из указанных выше недостатков был устранен, однако второй и третий сохранились (рис. 2). Развивая логически подход А. Вернера, можно устранить и второй недостаток, поместив аналогичным образом в таблицу и f-элементы, но тогда число групп возрастет до 32 и таблица, образно говоря, «раздастся вширь». Тут стоит напомнить, что нынешнее число известных химических элементов (117) – это еще отнюдь не конец их «мира», и на подходе еще одна, пока что неизвестная химикам их категория – 18 5g-элементов, первый из которых согласно современной теории строения атома должен иметь заряд ядра Z = 121, последний – 138, и после их открытия число групп в «длиннопериодическом» варианте возрастет до 50 (!). Что весьма неудобно для пользователей. Заметим в связи с только что сказанным, что в настоящее время главный международный орган химиков – International Union of Pure and Applied Chemistry (IUPAC) настоятельно рекомендует использовать для научных изысканий и в образовательном процессе длиннопериодический вариант (рис. 3), который благодаря этому и принят ныне во всем «западном мире». У нас же в России руководствуются иными соображениями; во всяком случае, и школьники, и студенты тех вузов, где вообще хоть как-то да изучается химия, явно предпочитают короткопериодический вариант. И, уверен, не потому, что «Менделеев – наш, а Вернер – не наш», а потому, что короткопериодический вариант куда компактнее длиннопериодического, да и номера групп в нем имеют хоть какой-то да физико-химический смысл (в отличие от номеров групп в длиннопериодическом варианте). Как бы то ни было, последний, третий из указанных выше недостатков «табличного» варианта оказывается не устраненным даже в «супер-длиннопериодическом» формате. А потому стоит подумать, нельзя ли как-то модифицировать табличный вариант Периодической системы, дабы ликвидировать – хотя бы частично – вышеуказанные недостатки.
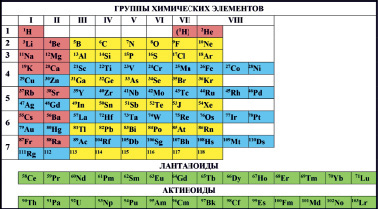
Рис. 1. «Короткопериодический» табличный вариант Периодической системы химических элементов
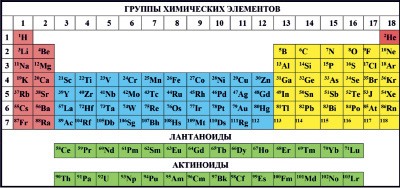
Рис. 2. «Длиннопериодический» табличный вариант Периодической системы химических элементов
Общий методологический подход
В короткопериодическом варианте положение конкретного элемента определяется двумя параметрами – заряда ядра Z, совпадающим с порядковым номером элемента, и его наивысшей возможной степенью окисления. Подобный принцип «заселения» элементов в целом хорошо оправдывается, однако степень окисления (в том числе и максимальная) – это лишь одно из свойств химического элемента, которое, равно как и все другие, есть лишь следствие проявления одной и ток же ПРИЧИНЫ – электронной структуры атомов химического элемента. Получается, что в качестве одного из параметров, определяющих положение конкретного элемента в периодической системе, мы выбираем во всех случаях то свойство, которое является как бы производным от некоторой причины, что, очевидно, уже само по себе не вполне логично.
Д.И. Менделеев, как известно, вскрыл факт закономерного изменения свойств химических элементов с ростом атомных масс и сформулировал Периодический закон, но не смог объяснить саму причину периодичности. Что не удивительно – в его время теории строения атома еще не существовало, и он при построении своей системы, не располагая данными о причине явления, вынужден был ориентироваться на то его следствие (в данном случае – некоторое свойство элемента), в свете которого сама «периодичность химических элементов» выглядела бы наиболее рельефно. Этим свойством оказалась максимальная степень окисления элемента, хотя и при ее использовании в качестве второго параметра (наряду с атомной массой) при построении системы элементов без определенных издержек не обошлось. У нас же есть одно, весьма существенное преимущество перед Д.И. Менделеевым: мы знаем причину периодичности и ее нарушений и то, что и то, и другое прямо связаны со спецификой заполнения электронами атомных орбиталей (АО) и соответственно – электронным строением атомов. Именно его и следует взять в качестве второго параметра при построении системы химических элементов. Начать же ее, на мой взгляд, следует с устранения того самого недостатка, который присущ ЛЮБОМУ современному табличному варианту Периодической системы – что короткопериодическому, что длиннопериодическому, а именно – ликвидации тех самых шести пустых клеток, о которых уже упоминалось выше. Для этого взглянем на сложившуюся ситуацию под иным утлом зрения и поместим в самом начале, в ее верхнем левом углу водород H, а за ним без каких бы то ни было промежутков следующие за ним элементы в порядке возрастания заряда ядра Z: He, Li, Be, B, C, N и т.д. Внимательно присмотревшись к их свойствам, мы вплоть до кислорода включительно не обнаружим похожих друг на друга элементов ни по химическим свойствам, ни – что еще более важно – по строению внешних электронных оболочек. А вот девятый по счету химический элемент – F пусть далеко не во всем, но как раз в главком – строении электронной оболочки, которую мы взяли в качестве второго параметра при построении таблицы элементов – уже может рассматриваться как аналог H, ибо обоим этим элементам до заполнения внешней электронной не хватает по одному электрону, пусть даже их электронные конфигурации и существенно различаются (1s1 – у водорода и 2s22p5 – у фтора). Следующий же элемент – Ne по своему электронному строению аналогичен He и подобно ему имеет полностью заполненные АО (хотя и здесь имеет еще место различие в электронных конфигурациях: He – 1s2, Ne – 2s22p6). Далее аналогия в строении электронных оболочек становится полной: Li и Na – 2s1 и 3s1соответственно, Be и Mg – 2s2 и 3s2, B и Al – 2s22p1 и 3s23p1 и т.д. до S, оказывающейся аналогом O (2s22p4 и 3s23p4 соответственно). Обратим теперь внимание вот на какое обстоятельство: у третьего по счету элемента в периодической системе – Li на внешнем слое находится один электрон, у четвертого – Be – два, у пятого – B – три и т.д. до O, у которого шесть электронов. И вполне естественно поместить их в группы, придав им номера, соответствующие числу электронов на внешнем слое: тогда Li окажется в группе I, Be – в группе II, O – в группе VI. А вот гелий имеет устойчивую двухэлектронную оболочку 1s2 и нулевую степень окисления, ибо на внешней электронной оболочке у него де-факто нет ни одного электрона. В соответствии с указанной выше логикой нумерации групп химических элементов его следует поместить в нулевую группу, но не в VIII, как это сделано в современном короткопериодическом (и тем более – не в XVIII, как в длиннопериодическом!) варианте. Кстати, сам Д.И. Менделеев в первоначальном СВОЕМ варианте периодической системы выделил гелий и все остальные аналогичные ему элементы (т.н. инертные газы) именно в нулевую группу и был категорически против их размещения в группе восьмой. А вот у самого первого элемента системы – водорода до заполнения внешней электронной оболочки не хватает одного электрона, и теперь в полном соответствии с вышеуказанной логикой его следует поместить в минус первую группу. Решение это кажется парадоксальным, однако оно позволяет полностью ликвидировать все пустые клетки в первом периоде. Продолжая же «заселение» химических элементов в указанную выше таблицу, мы легко сможем разместить в ней все известные ныне химические элементы в рамках принципа «номер группы = число электронов на внешней оболочке». Некоторые сложности, правда, возникают с Co и Ni, а также их аналогами, имеющими аналогичную электронную конфигурацию (n-1)d7ns2 и (n-1)d8ns2 соответственно – Rh и Pd по той простой причине, что число электронов на валентных уровнях у них равно 9 и 10 соответственно. В современном варианте периодической системы, равно как и в первоначальной ее интерпретации самого Д.И. Менделеева, они помещены вместе с Fe и его аналогом – Ru в одной обширной восьмой группе, что уже само по себе выглядит неестественным [4]. Кроме того, парам Co-Rh и Ni-Рd вообще нет аналогов среди всех элементов от первого до 57-го, и поэтому их следует поместить в две самостоятельные группы, а именно в IX и X соответственно. Тот же самый принцип «заселения» может и должен быть использован и для f-элементов. Первый из них – Ce с Z = 58 имеет сокращенную электронную конфигурацию внешних АО 4f 26s2 и четыре валентных электрона, так что ему место в группе IV, а не в III, где он ныне значится. Аналогично расположатся в таблице и другие 4f-элементы: Pr с конфигурацией 4f 36s2 – в V, Sm (4f 66s2) – в VIII, Tb (4f96s2) – в XI и т.д. вплоть до Er (4f 126s2), который займет клетку в группе XIV. Следующий же за ним элемент – Tm (4f 146s1) с полностью заполненным электронами 4f-АО и одним электроном на 6s-АО, должен быть помещен в группу I. И, наконец, два последних 4f-элемента – Yb и Lu займут соответствующие клетки в группах II и III группах. Разместить остальные известные ныне химические элементы после всего сказанного уже не составит большого труда, и в итоге система химических элементов приобретает вид, представленный на рис. 3. В этом новом формате f-элементы располагаются наравне с остальными элементами в соответствующих группах; более того, даже сами понятия «лантаноиды» и «актиноиды» теряют свой изначальный смысл. Да и внешне новая таблица выглядит изящнее по сравнению как с короткопериодическим, так и с длиннопериодическим вариантами.
Некоторые новые параллели и закономерности
Даже беглого взгляда на новый вариант таблицы химических элементов (рис. 3) достаточно, чтобы отметить: исчезли все неопределенности, связанные с положением водорода (равно как ж пустые клетки между ним и гелием), более четким и определенным стало положение галогенов, инертных газов, лантаноидов и актиноидов. Вместо семи периодов современной периодической системы предлагаемая нами система содержит лишь ТРИ. Число элементов в каждом периоде определяется соотношением N = 4(n + 1)2, где n – номер периода. Здесь намечаются новые закономерности, остающиеся либо невскрытыми, либо необъяснимыми в рамках любого из современного «табличных» вариантов периодической системы. Отметим лишь некоторые из них.

Рис. 3. Модифицированный табличный вариант Периодической системы химических элементов
До появления т.н. актиноидной концепции Сиборга наиболее употребительным был несколько иной вариант периодической системы, в которой Th, Pa и U помещались соответственно в IV, V и VI группах, после чего шли так называемые «трансурановые элементы», которые выносились из основной таблицы в виде отдельного «приложения». А в учебниках химии вплоть до 70-х гг. XX в. Th рассматривался как аналог Ti, Zr и Hf, Ра – как аналог V, Nb и Та, U – как аналог Cr, Mo и W. Позднее Th, Pa и U перевели в когорту актиноидов, а позиции, которые они занимали, до поры до времени оставались вакантными. В настоящее время они заняты элементами с номерами 104 (Rf), 105 (Db) и 106 (Sg). В рамках актиноидной концепции, однако, оставалось (да и сейчас еще остается) непонятным, почему первые элементы этого ряда – от Ра до Cm – проявляют степени окисления, значительно превышающие +3, хотя формально актиноиды примыкают к третьей группе. Предлагаемый же нами вариант периодической системы дает на это ответ: Th, Ра и U оказываются в ней именно в группах IV, V и VI соответственно, так что максимальные степени окисления этих элементов (+ 4, + 5 и + 6) выглядят естественными и ожидаемыми. Более того, Np располагается здесь в седьмой группе, Рu – в восьмой, так что наличие у обоих элементов степени окисления + 7, а у Pu – даже и + 8 [5] вполне понятно. Еще более интересным оказывается то, что помещенные в первую группу Tm и Md в ряде случаев проявляют степень окисления + 1, причем у последнего в кислых растворах она становится основной и менделевнй из этих растворов осаждается вместе с труднорастворимыми соединениями s-элементов I группы. Заметим в связи с этим, что, насколько нам известно, больше ни у одного из f-элементов такой степени окисления не отмечено. К примеру, Yb и его аналог – No во многих соединениях проявляют степень окисления +2, напоминая в этом отношении своих соседей по второй группе – Sr, Ba и Ra. Металлический иттербий, подобно металлическим стронцию и барию, растворяется в жидком NH3, а YbSO4 и NoSO4 столь же плохо растворимы в воде, как и тетраоксосульфаты(VI) Sr, Ba и Ra. А первая триада f-элементов VIII–X групп (Sm, Eu, Gd) подобно первой триаде d.-элементов из этих же групп (Fe, Co, Ni) обладает довольно хорошо выраженным ферромагнетизмом.
В неорганической химии давно известен один любопытный факт, который может быть назван «эффектом пар» [1, 2, 6]. Смысл его сводится к тому, что по степени близости своих физико-химических характеристик элементы каждой из групп как бы сгруппированы (при движении по группе сверху вниз) попарно, причем различия между элементами в пределах одной пары заметно меньше, чем между элементами, находящимися в разных близлежащих парах. Например, во второй группе «попарное деление» дает пары Be-Mg, Са-Sr и Ва-Ra; так вот, различие между Mg и Ca заметно больше, чем между Mg и Be, между Sr и Ba – больше, чем между Ba и Ra н т.д. Это обстоятельство в рамках любого из современных табличных вариантов периодической системы – как короткопериодического, так и длиннопериодического – не удается объяснить с достаточной наглядностью. В предлагаемом же нами варианте (см. рис. 3) оно представляется вполне естественным: ведь Be и Mg относятся к первому периоду, Са и Sr – ко второму, Ва и Ra – к третьему.
Существует, однако, следующее возражение против описываемого нами «гибридного« табличного варианта периодической системы: в ней теперь станет больше несоответствий между номером группы и проявляемой химическим элементом максимальной степени окисления. Едва ли, например, Rh и Pd будут способны проявлять в своих сколько-нибудь устойчивых химических соединениях степени окисления + 9 и + 10, или Bk – + 11. Однако степень окисления – это всего лишь одна из «граф» в «анкете» химического элемента и уже по этой причине она не может служить мерилом ценности той или иной их системы. Кстати, и современный вариант периодической системы по части соответствия между номером группы, где находится химический элемент, и максимальной степенью его окисления также не является в полной мере совершенным.
Как бы то ни было, одним из решающих критериев, определяющих той или иной теории, является предсказание новых фактов, до того времени не наблюдавшихся. Что можно предсказать, используя предлагаемый нами вариант системы элементов? Вот лишь один пример на этот счет.
Давно замечено, что 5f–АО по числу используемых для образования химических связен электронов весьма напоминает 4d-АО: U по своим возможным степеням окисления повторяет Мо, Nр – Тс, Am – Rh и Pd – Cm. Поэтому можно ожидать, что аналогичное сходство должно отмечаться и в степенях окисления пары Ru-Pu. Максимальная степень окисления Ru, как известно, равна +8 и можно ожидать, что такая же степень окисления должна проявляться и у Pu. И относительно недавно были обнаружены соединения, где Pu действительно проявляет эту степень окисления (см., например, [5]). Более того, можно даже ожидать, что «сосед» Pu – Am окажется способным проявить степень окисления + 9 (на данный момент максимальная степень окисления этого элемента – + 7). Правда, ни для одного из известных химических элементов такая степень окисления до сих пор неизвестна….

