Вирусный гепатит С является одной из наиболее актуальных медико-социальных проблем в мире, обусловленный повсеместным распространением с неуклонной тенденцией к росту, а также значительными экономическими затратами на диагностический и лечебный процессы [1, 3, 5, 7].
Комбинация методов лечения, направленных на непосредственную ингибицию вирусной репликации и индукцию сильного HCV-специфического иммунного ответа, определяет благоприятный исход болезни. «Золотой стандарт» современной схемы противовирусной терапии, включающий интерферон-α (ИФН-α) или пегилированный интерферон-α (ПИФН-α) в сочетании с рибавирином, позволяет достичь стабильной ремиссии у 40,0 – 95,0 % больных [2, 6, 8].
Цель исследования – оценка эффективности комбинированной противовирусной терапии ХГС с использованием пегилированного ИФН –α 2А с рибавирином.
Материалы и методы исследование
Мы проанализировали эффективность лечения 32 больных ХГС, вызванным генотипом HCV «не 1» (1-я группа) и 43 больных, вызванным генотипом HCV 1 (2-я группа), которым была проведена противовирусная терапия пегилированным интерфероном – ПЭГ-ИФН-α-2а (пегасис, фирма Hoffmann la Roche, Швейцария) дозе 180 мкг 1 раз в неделю подкожно и рибавирин. Дозы рибавирина при генотипе 1 составляли 1000 – 1200 мг/сут., при 2 и 3 генотипах – 800 мг/сут. Длительность курса противовирусной терапии составила 48 недель при генотипе 1, и 24 недели при генотипах 2 и 3.
Для определения показаний к противовирусной терапии проводился комплекс клинических и лабораторно-инструментальных исследований. Клиническое обследование включало сбор и анализ следующих данных: пол, возраст, социальную адаптированность, сопутствующие и перенесенные заболевания, предполагаемый срок и путь инфицирования, проведенная и сопутствующая терапия, вес, наличие диабета и других сопутствующих заболеваний. Лабораторно-инструментальные исследования включали определение анти-HCV, биохимических показателей (АЛТ, АСТ, билирубин, протромбиновое время, индекс, креатинин, ЩФ), общий анализ крови и мочи, ТТГ, генотип вируса и уровень вирусной нагрузки, состояние глазного дна, ЭКГ, УЗИ и фиброэлестографию печени.
Принципы лабораторного мониторинга при проведении терапии ПЭГ-ИФН-α2А + рибавирин представлены в табл. 1.
Учитывая то обстоятельств, что генотип HCV является основным фактором, определяющим эффективность противовирусной терапии, пациенты были распределены в две группы в зависимости от генотипа: а) пациенты с генотипом HCV 1 и б) пациенты с генотипом HCV «не 1». Оценку эффективности проводимой терапии в ходе исследование оценивали на 12, 24, 48 неделие лечения и на 24 неделе после ее окончания. На 12 неделе осуществлялась первичная оценка эффективности проводимого лечения ‒ показатель раннего вирусологического ответа (РВО), на 24 или 48 неделе оценивали эффективность терапии по окончании лечения – первичный вирусологический ответ (ПВО) для 24-и 48-недельных курсов соответсвенно. Далее на 24 неделе после окончания лечения оценивали показатель стабильного вирусологического ответа (СВО).
Среди больных 1-й группы было 21 мужчин (65,6 %) и 11 женщин (34,4 %) в возрасте от 18 до 59 лет (средний возраст – 35,4 ± 3,22 года). Группу 2 составляли 28 мужчина (65,2 %) и 15 женщины (34,8 %), в возрасте 20-29 лет –17 чел. (39,5 %), 30-39 лет –15 чел. (34,9 %), 40-49 лет –10 чел. (23,3 %), 50-59 лет – 1 чел.(2,3 %) средний возраст – 36,2 ± 6,3 лет.
Репликативная активность HCV в обеих группах была одинаковой и в среднем среди всей группы больных в 66,6 % была высокой и в 33,4 % – низкой. Также не выявлено отличий в подгруппах в степени фиброза, а в целом в группе ее показатели составили: F0 – 12,4 %, F1 – 45,2 %, F2 – 26,1 % и F3 – 16,7 %.
Таким образом, в исследованных группах не было различий по половому и возрастному составу, а также по репликативной активности HCV и степени выраженности фиброза.
Результаты исследования и их обсуждение
Анализ взаимосвязи быстрого вирусологического ответа с последующим стойким вирусологическим ответом у 43 больных ХГС, обусловленным генотипом HCV 1 и 32 больных с генотипом HCV «не 1» представлен в табл. 2. Как видно из этих показателей, ранний вирусологический ответ в обеих группах был одинаков.
Однако стойкий вирусологический ответ в группе больных ХГС, обусловленным генотипом HCV 1, имел место в 67,4 %, в то время как в группе, в которой болезнь была обусловлена генотипа HCV «не 1» – в 87,5 % случаев, т.е. в 1,3 раз чаще (p < 0,05).
При анализе влияния пола больных на эффективность противовирусной терапии выявлена некоторая тенденция более частого СВО у женщин – 90,9 %, чем у мужчин – 85,7 % в группе ХГС (рис. 1), у которых вызван генотипом HCV «не 1», а в группе больных ХГС, обусловленным генотипом HCV 1 у женщин – 73,3 % и мужчин – 67,8 % случаев СВО.
Но более выражено влияние на эффективность терапии возрастного фактора, в возрастной группе 20-29 лет в 92,3 % (рис.2) случаев СВО генотипом HCV «не 1», и ниже в возрастной группе 40-49 лет в 75 % случаев СВО. Тогда как пациенты с генотипом HCV 1 в возрастной группе 20-29 лет в 70,6 % случаев СВО и ниже в возрастной группе 40-49 лет в 63,6 %.
Таблица 1
Принципы лабораторного мониторинга при проведении терапии ПЭГ-ИФН-α + рибавирин
|
Мероприятия |
Сроки |
|
В период проведения терапии |
|
|
Клинический анализ крови Биохимический анализ крови |
Каждые 4 недели по требованию |
|
HCV РНК количественно, качественно |
Недели: 4, 12, 24, 36, 48 |
|
ТТГ |
Каждые 12 недель |
|
По завершению терапии |
|
|
Общий анализ крови Биохимический анализ крови ТТГ |
Недели: 12, 24, 48, 96 |
|
HCV РНК качественный анализ |
|
Таблица 2
Эффективность противовирусной терапии больных ХГ С комбинацией пегасис + рибавирин с учетом генотипа HCV
|
HCV |
РВО |
ПВО |
СВО |
|
Генотип 1 n = 43 |
40 чел. 93,0 % |
35 чел. 81,4 % |
29 чел. 67,4 % |
|
Генотип «не 1» n = 32 |
28 чел. 93,7 % |
29 чел. 90,6 % |
28 чел. 87,5 % |
Примечание. РВО – ранний вирусологический ответ; ПВО – первичный вирусологический ответ; СВО – стойкий вирусологический ответ.
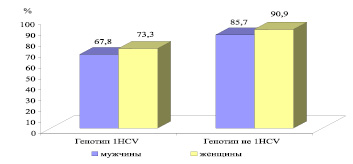
Рис. 1. Показатели частоты стойкого вирусологического ответа на терапию ПИФН + рибавирин в зависимости от пола ( %)
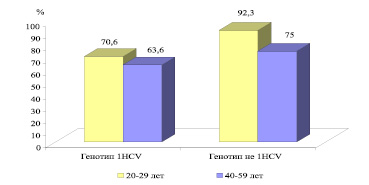
Рис. 2. Показатели частоты стойкого вирусологического ответа на терапию ПИФН + рибавирин в зависимости от возрастного фактора ( %)
Оценка уровня репликативной активности в группе больных ХГС, с генотипом HCV «не 1», показала значительное влияние на ответ противовирусный терапии. Так у 11 из 32 больных с показателем вирусной нагрузки > 400 000 МЕ/мл стабильный вирусологический ответ выявлен в 81,8 % случаев (рис. 3), а при показателе < 400 000 МЕ/мл – у 21 из 32 пациентах в 95,2 % случаев СВО. Однако стойкий вирусологический ответ в группе больных ХГС, обусловленным генотипом HCV1 отмечается у 66,7 % случаев из 43 больных с показателем вирусной нагрузки > 400 000 МЕ/мл, и несколько больше при показателе < 400 000 МЕ/мл – 67,9 % случаев СВО.
Анализ влияния степени фиброза печени на показатели стабильного вирусологического ответа показал, что у больных ХГС, вызванным генотипом HCV «не 1» отмечается увеличение эффективности при нулевой, минимальной и умеренной степени фиброза печени (рис. 4), а при выраженной степени фиброза снижается (F0-75 %, F1-86,7 %, F2-87,5 % и F3-60 %). Стойкий вирусологический ответ в группе больных ХГС, обусловленным генотипом HCV-1 отмечается снижением эффективности лечения от выраженности фиброза (F0-80 %, F1-70 %, F2-63,6 % и F3-57,1 %).
Накопленный клинический опыт и анализ фактического материала показал, что к факторам, связанным с плохим ответом на противовирусную терапию относятся:
а) постоянные: генотип HCV 1, возраст, уровень виремии, цирроз, внепеченочные проявления;
б) предшествующие лечению: наркомания, жировой гепатоз, ожирение/метаболический синдром,
в) развивающиеся во время лечения: несоблюдение режима лечения, медикаментозные осложнения.
Эти факты дают основание выделять группу пациентов с неблагоприятным факторами, в первую очередь, в целях возможности коррекции некоторых из них еще до лечения. Выделение таких факторов, как выраженный фиброз,/цирроз, возраст (старше 40 лет) наличии внепеченочных проявлении HCV-инфекции, в качестве неблагоприятных показателей стойкого вирусологического ответа, диктует к активной тактике и своевременному лечению с целью недопущения перехода пациента в группу с отсутствием СВО.
Исследования также выявили отрицательное влияние внепеченочных проявлений HCV-инфекции на эффективность противовирусной терапии. Это обосновывает тактику проведения противовирусного лечения на ранних стадиях заболевания еще до развития внепеченочных проявлений. При их наличии своевременная диагностика внепеченочных проявлений, часто протекающего инфекционного процесса латентно, и правильная их оценка улучшают эффективность терапии, а кроме того, позволяют предупредить осложнения противовирусной терапии и улучшить прогноз.
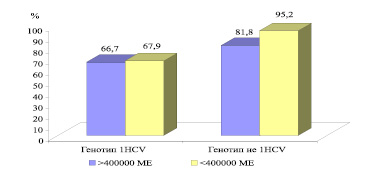
Рис. 3. Показатели частоты стойкого вирусологического ответа на терапию ПИФН + рибавирин в зависимости от репликативной активности HCV ( %)
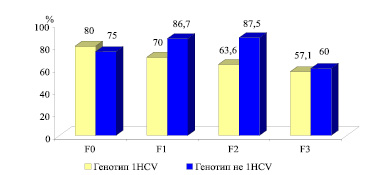
Рис. 4. Показатели частоты стойкого вирусологического ответа на терапию ПИФН + рибавирин в зависимости от степени фиброза ( %)
Заключение
Установлена эффективная противовирусная терапия с использованием пегилированного интерферона-α в комбинации с рибавирином для лечения больных ХГС независимо от генотипа вируса. В группе больных генотипом 1 СВО достигли 67,4 % случаев, при генотипе «не-1» – в 87,5 % случаев.

