Проблема ранней диагностики, рационального лечения и профилактики гнойно-воспалительных заболеваний лица и шеи остается одной из актуальных в челюстно-лицевой хирургии [1, 6]. Это объясняется изменением клинического течения воспалительных заболеваний, зависящего от наличия сопутствующей патологии, воздействия эндогенных и средовых факторов, снижающих иммунологическую реактивность организма [3, 4]. Сложная ситуация в современной хирургии обусловлена изменением этиологической и экобиологической сущности гнойно-воспалительных процессов в результате повышения резистентности микроорганизмов к применяемым антибактериальным препаратам и снижения иммунобиологической реактивности макроорганизма под влиянием техногенных факторов [2, 5].
Цель исследования
Изучить влияние вакуум-терапии на фазы раневого процесса при острых разлитых одонтогенных гнойно-воспалительных процессах челюстно-лицевой области.
Материалы и методы исследования
Нами была изучена динамика цитологических нормативов процесса заживления гнойных ран у 52 больных с одонтогенными флегмонами. Среди обследуемых было 25 женщин, и 27 мужчин. Возраст больных колебался от 19 до 58 лет. Все пациенты были разделены на две группы. В первой группе применяли традиционные методы послеоперационного лечения. Рану дренировали трубками из полихлорвинила, которые в последующем меняли на мазевые повязки. Ежедневно делали перевязки, рану промывали антисептиками, меняли дренажи.Во второй группе применяли вакуум-промывное дренирование с использованием предложенного на кафедре челюстно-лицевой хирургии и стоматологии СамГМУ устройства для вакуумной непрерывной терапии гнойных ран (патент на полезную модель RU 129818). В качестве дренажа использовали устройство из нетканого титанового материала капиллярно-пористой структуры – металлорезины (МР) (патент на полезную модель RU 129819).
Один конец дренажа из МР укладывали на дно раны, другой его конец через рану или через дополнительный разрез выводили на кожу. Рану закрывали наглухо адгезивной изолирующей плёнкой. К отводящей трубке присоединяли аспирационно-вакуумное устройство, обеспечивающее заданное стабильное отрицательное давление (– 125 мм рт.ст.) в герметичных полостях. Сбор биологического материала производили в контейнер. К приводящей трубке через систему подведения лекарственного препарата подключали программно-аппаратный комплекс для осуществления подачи лекарственного средства.
Предложенное дренажное устройство обладает высокой площадью пористости, равномерно адаптируется к краям раны, предотвращает возможность спадания и тромбирования, имеет возможность диализа раны и повторного использования. Стенки открытых пор дренажа прикрепляются к раневому ложу, в то время как внутренняя часть пор не входит в соприкосновение с раной. Таким образом, за счет локального отрицательного давления происходит растяжение и деформация ткани раневого ложа. Это вызывает деформацию клеток вакуумируемых тканей и стимулирует миграцию и пролиферацию клеток.
С целью определения эффективности выбранного способа лечения и суждения об иммунологических силах организма и регенеративных процессах в ране проводили цитологическое исследование мазков-отпечатков с раневой поверхности.
Перед изготовлением отпечатка осторожно удаляли с поверхности раны стерильным марлевым тампоном, увлажненным изотоническим раствором натрия хлорида, раневой экссудат, затем перпендикулярным прикосновением к поверхности раны стерильным и обезжиренным в спирт-эфире стеклом получали на последнем отпечаток. При этом не допускали сильного надавливания стеклом на раневую поверхность и скользящих движений во избежание деформирования клеток. С одного и того же участка раны последовательно брали 4-5 отпечатков. В первом отпечатке преобладали клетки раневого экссудата и гнойный детрит. В последующие отпечатки, особенно в последние два, попадали клетки и микроорганизмы, находящиеся на раневой поверхности, в том числе клетки пролиферата (поверхностного слоя грануляционной ткани), имеющие наибольшее диагностическое значение. Отпечатки брали с возможно большей поверхности или с нескольких участков раны, так как регенеративные процессы и распределение клеток по раневой поверхности неравномерны, а иногда противоположны.
Полученные препараты высушивали на воздухе, маркировали, окрашивали по методу Лейшмана, смывали дистиллированной водой, высушивали на воздухе. Цитологическое исследование проводили с помощью светового микроскопа «Zeiss».
Результаты исследования и их обсуждение
Цитологическое исследование процесса заживления ран при одонтогенных флегмонах осуществляли в динамике: мазки-отпечатки с раневой поверхности исследовали на 1-е, 3-и, 5-е, 7-9-е сутки после начала применения вакуум-терапии (табл. 1).
Сначала в препаратах наблюдали лейкоцитарную реакцию разной степени выраженности – от слабой до сильно выраженной (рис. 1), что соответствует ранней стадии воспалительного процесса (I тип цитограммы по Камаеву М.Ф., 1970).
При этом на 1-е сутки качественный состав лейкоцитов был резко сдвинут в сторону преобладания сегментоядерных нейтрофилов, что указывает на активность защитной реакции организма в борьбе с инфекцией. На фоне свободно лежащей микрофлоры определяли массивные скопления детрита. Такая картина оставалась практически неизменной и в последующие периоды взятия мазков-отпечатков, что свидетельствует о выраженных процессах фагоцитоза. Уже к 3-м суткам в препаратах чаще стали встречаться дегенеративно-измененные формы нейтрофилов, что соответствует дегенеративно-некротической стадии воспалительного процесса (II тип цитограммы).
Начиная уже с 3-х суток после начала применения вакуум-терапии происходило превращение моноцитов в макрофаги, обладающие большим спектром фагоцитарной активности.
В результате совместной деятельности нейтрофилов и макрофагов происходило уменьшение количества бактериальной флоры.
Таблица 1
Цитологическая картина в мазках-отпечатках с раневой поверхности при одонтогенной флегмоне после применения вакуум-терапии
|
Клеточный состав |
1-е сутки |
3-и сутки |
5-е сутки |
7-9-е сутки |
|
п/я лейкоциты, % |
0-3 |
3-5 |
5-20 |
3-5 |
|
с/я лейкоциты, % |
75-95 |
80-95 |
30-75 |
50-95 |
|
эозинофилы, % |
0 |
0 |
0 |
0 |
|
моноциты, % |
1-2 |
3-5 |
5-10 |
15-20 |
|
лимфоциты, % |
3-5 |
5-10 |
20-60 |
15-25 |
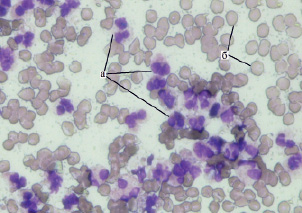
Рис. 1. Выраженная лейкоцитарная реакция в мазке-отпечатке с раневой поверхности при одонтогенной флегмоне: а – нейтрофилы; б – эритроциты, ув. х400
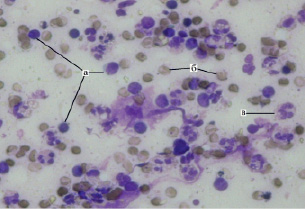
Рис. 2. Лимфоциты в мазке-отпечатке с раневой поверхности при одонтогенной флегмоне, 5-е сутки вакуум-терапии: а – лимфоциты; б – эритроцит; в – дегенеративно-измененный нейтрофил, ув. х400
Неуклонно увеличивалось и к 5-м суткам достигало апогея число лимфоцитов (рис. 2), что говорит о формировании в этот период специфического иммунного ответа в ране.
Эти данные можно отнести к III типу цитограммы, соответствующему дегенеративно-воспалительной стадии. В дальнейшем, на 7–9 сутки, в период интенсивной эпителизации раны, количество лимфоцитов снижается. Таким образом, изменения количества лимфоцитов при исследовании раневого содержимого в ходе вакуум-терапии может служить показателем состояния специфического иммунитета в ходе репаративных процессов в ране.
На 3-и сутки применения вакуум-терапии среди нейтрофилов значительно увеличивалось количество клеток с явлениями фагоцитоза микробов. Между клетками встречались лишь единичные кокки и палочки, которые находились в отдельных набухших и вакуолизированных макрофагах.
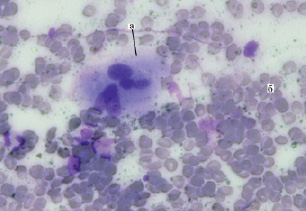
Рис. 3. Гистиоцит в мазке-отпечатке с раневой поверхности при одонтогенной флегмоне: а – гистиоцит; б – эритроцит, ув. х400
Таблица 2
Цитологическая картина в мазках-отпечатках с раневой поверхности при одонтогенной флегмоне с применением стандартной терапии.
|
Клеточный состав |
1-е сутки |
3-и сутки |
5-е сутки |
7-9-е сутки |
|
п/я лейкоциты, % |
0–1 |
1–3 |
0–1 |
0–1 |
|
с/я лейкоциты, % |
93–95 |
80–90 |
85–90 |
80–85 |
|
эозинофилы, % |
0 |
0 |
0 |
0 |
|
моноциты, % |
1–2 |
3–5 |
3–5 |
3–5 |
|
лимфоциты, % |
2–3 |
7–10 |
5–10 |
8–10 |
Наряду с процессами интенсивного очищения раны в этот период появлялись признаки формирования грануляционной ткани. Морфологическим отражением данного процесса послужило появление в цитологических препаратах фибробластов и гистиоцитов (рис. 3), что свидетельствует о появлении цитограммы IV-го, регенеративного, типа первой фазы воспалительного процесса.
В последующие периоды взятия мазков-отпечатков значительно увеличивалось количество основных клеток соединительной ткани.
Параллельно с этим начиналась эпителизация раны, в препаратах появлялись молодые эпителиальные клетки с базофильной цитоплазмой, что соответствует цитограмме V типа и свидетельствует о наступлении второй фазы воспалительного процесса. В дальнейшем происходит дифференцировка этих эпителиальных клеток, они становятся функционально активными в отношении фагоцитоза микрофлоры, лейкоцитов и эритроцитов раневого содержимого.
Цитологическое исследование заживления ран с применением стандартной терапии осуществляли в динамике: мазки-отпечатки с раневой поверхности исследовали на 1-е, 3-и, 5-е, 7-9-е сутки (табл. 2).
В цитологических препаратах наблюдали сильно выраженную лейкоцитарную реакцию, соответствующую ранней стадии воспалительного процесса и I-му типу цитограммы.
Во все периоды взятия мазков-отпечатков клеточный состав был представлен большим количеством полиморфно-ядерных лейкоцитов, что указывает на активность защитной реакции организма в борьбе с инфекцией. Дегенеративно-измененные формы нейтрофилов появлялись в мазках-отпечатках к 5-м суткам проведения стандартной терапии, что свидетельствовало о более позднем наступлении дегенеративно-некротической стадии воспалительного процесса (II тип цитограммы) по сравнению с полученными результатами при проведении вакуум-терапии.
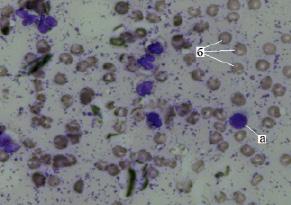
Рис. 4. Лимфоцит в мазке-отпечатке с раневой поверхности при одонтогенной флегмоне: а – лимфоцит; б – эритроцит, ув. х400
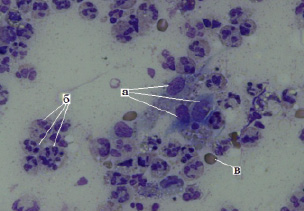
Рис. 5. Фибробласты в мазке-отпечатке с раневой поверхности при одонтогенной флегмоне: а – фибробласт; б – нейтрофил, ув. х400
Количество моноцитов практически не менялось при исследовании цитограмм в разные периоды взятия мазков-отпечатков, составляя в среднем 3–5 %. Превращение их в макрофаги происходило к 5-м суткам проведения стандартной терапии.
Количество лимфоцитов во все периоды взятия цитологических препаратов было незначительным и, начиная с 3-х суток стандартной терапии, практически не менялось, составляя в среднем 8–10 %, что свидетельствовало об отсутствии в ране специфических иммунологических реакций (рис. 4).
Появление фибробластов в цитопрепаратах при использовании стандартной терапии происходило к 5–7-м суткам (рис. 5), что свидетельствовало о более позднем наступлении регенеративных процессов в ране по сравнению с таковыми при применении вакуум-терапии.
Выводы
Таким образом, цитологический метод исследования динамики заживления гнойных ран челюстно-лицевой области свидетельствует о том, что у всех больных раневой процесс носит отчетливо выраженный фазный характер. Полученные результаты указывают на активность защитной реакции организма в борьбе с инфекцией при одонтогенных флегмонах на фоне применения вакуум-терапии и стандартной терапии. Однако появление нейтрофилов с массовыми дегенеративными изменениями клеток указывают на активизацию вирулентной микрофлоры, медленнее подвергающейся уничтожению в результате применения стандартных методов лечения. Время наступления различных фаз воспалительного процесса в результате применения вакуум-терапии также отличается от таковых при применении стандартного метода лечения. Так, уже с 3-х суток после начала применения вакуум-терапии отмечается макрофагальная реакция в мазках-отпечатках с раневой поверхности, что указывает на эффективность лечения. В этот же период начинается интенсификация регенеративных процессов в ране, а при стандартной терапии – лишь к 5–7-м суткам от начала лечения.
Все это позволяет сделать вывод, что динамический контроль применения вакуум-терапии и стандартной терапии при одонтогенных флегмонах с помощью цитологической оценки мазков-отпечатков с раневой поверхности дает возможность объективно определить фазу течения раневого процесса и эффективность применяемого метода лечения, и, в случае необходимости, своевременно провести коррегирующую терапию.

