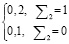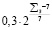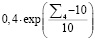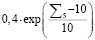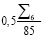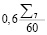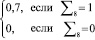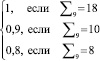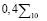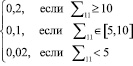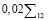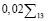В настоящее время ухудшение экологических условий проживания человека, усиление роли социального фактора на психологическое, психическое и физическое состояние человека, ускоренное уменьшение людей постоянно проживающих и-или работающих в сельской местности приводит к ухудшению популяционных свойств [4, 5]. В связи с этим существенно повышаются требования к качеству массового периодического обследования населения (в том числе в ходе диспансеризации) населения с применением скрининга, стандартизации и унификации методов превентивной медицины, искусственного интеллекта и IT-технологий с использованием достижений в областях вычислительной техники.
Например, в Российской Федерации, начиная с конца XX века, ведутся разработки в области проектирования и эксплуатации систем поддержки принятия решений скрининга здоровья детей и подростков (системы ВИТА-90, АКДО, АСПОН, КМАДО, АСДОК, САНУС, КАСМОН и др.) [3]. Аналогичные проекты реализованы и продолжают активно разрабатываться в США (фирмы «Control Date Corp», «GETZ CORP») и в других странах [9].
Базовая автоматизированная система поддержки принятия решений процесса скрининг
диагностики включает в себя подсистемы: регистрации пациента автоинтервьюирования, проверки работы различных физиологических и сенсорных систем организма, анализа ЭКГ и артериального давления, результаты лабораторных анализов различных биологических проб. К настоящему времени разработаны и эксплуатируются системы скрининга различных заболеваний [3, 1]. К прогрессирующим заболеваниям, требующим качественную и своевременную диагностику на ранней стадии заболевания в процессе реализации технологий превентивной медицины, относятся онкологические. Например, нашли широкое применение технологии скрининг-диагностики (в том числе с применением автоматизированных систем поддержки принятия решений) нозологических заболеваний по выявлению рака: яичников, шейки матки, молочной железы, предстательной железы, легких, прямой кишки, мочевого пузыря, полости рта, кожи, поджелудочной железы [3]. Ранняя диагностика рака желудка в силу специфики протекания заболевания в процессе массовой диспансеризации осуществляется крайне редко, поскольку требует проведения достаточно дорогих и технологически сложных процедур и исследований на фоне, как правило, отсутствия жалоб специфического характера со стороны обследуемого. Применяются в основном методы фото-флюорографии с двойным контрастроированием и гастроскопией в специализированных центрах или клиниках. С этой целью применяется и онкомаркеры типа РЭА, СА242, СА72.4, СА19.9, с диагностической эффективность порядка 60-65 % [6]. Несвоевременная диагностика на ранней стадии приводит к росту летальности.
Указанные факторы обусловливают актуальность проведения исследований в области разработки достаточно формализованных для автоматизации методов скрининга заболеваний рака желудка на ранней стадии при массовых обследованиях населения без применения специализированных клинических исследований для повышения качества предоставляемых населению услуг медицинского и профилактического характеров, снижения смертности и экономических затрат на лечение и последующую реабилитацию больных, уменьшения последствий терапевтических воздействий (в первую очередь, химиотерапии и хирургического вмешательства).
Целью настоящего исследования являлась разработка формализованного метода диагностики возможности возникновения и-или наличия онкологических заболеваний желудка при скрининге на основе анализа результатов ответов на вопросы, отражающих: социальный статус обследуемого, наличие текущих и перенесенных заболеваний, образ жизни обследуемого.
Материалы и методы исследования
Для решения поставленной цели использовалась методологий системного анализа, синтез нечетких логических правил и математического моделирования при анализе различных рекомендаций, предложенных в доступных информационных источниках и консультациях с экспертами – врачами-онкологами [6, 7, 8].
Результаты исследования и их обсуждение
В процессе диагностического процесса с помощью представленной на рисунке 1 системы поддержки принятия решений (СППР) скрининг-диагностики рака желудка для лица, принимающего решение управляющего и корректирующего характеров [2] формируются следующие рекомендации о: необходимости дальнейшего обследования в специализированных медицинских центрах, подготовке сопровождающей документации, необходимости коррекции функционирования модуля «Подсистема формирования рекомендаций для СППР» с помощью «Подсистемы настройки», путем изменения классификационных пороговых значений для мер доверия и параметров функций соответствия, характеризующих «образ жизни» факторов, алгоритмов синтеза решающих правила, технологии формирования обучающей и контрольной выборок, базы данных для обучения СППР.
На рис. 1 используются следующие условные обозначения: БДПКО – база данных показателей общего анализа крови для обучения системы классификации; МФПММ – модуль формирования пакетов математических моделей; МИСП – модуль информационной селекции показателей; МРМДДиМ – модуль расчета мер доверия к данным и моделям; ТПА – таблица показателей анамнеза и «образа жизни» обследуемого (Q); МФИП – модуль формирования интегральных показателей; ППРР – пакет программ расчета рисков; МВМД – модуль вычисления мер доверия; МВ – модуль визуализации; МПДок – модуль подготовки документации; МПРС – модуль протоколирования работы системы поддержки принятия решений; МДС – модуль диагностики состояния обследуемого (на предмет выявления рака желудка); МПМБ – модуль параметров для расчета мер близости к альтернативным классах w0 и w1; МФРек – модуль формирования рекомендаций для ЛПР; ТКП – таблица классификационных порогов; МВФС – модуль вычисления значений функций соответствия результатов модельных вычислений и измерений; МВРА – модуль вычисления риска по анализу анамнеза и «образа жизни, истории болезни, жалоб и т.п.»; МРЗПМ – модуль расчета значений показателя по математическим моделям; МРМБ – модуль расчета меры близости; МФИДП – модуль формирования идентификационных данных пациента (по медицинской карте); БДПА – база данных показателей «образа жизни» и анамнеза; МИВТ – модуль идентификации временного тренда; ДО – данные для обучения системы; МПО – модуль прогноза оперативности обследования; ЛПР – лицо принимающее решение; «Подготовка мед. карты по ….» – модуль подготовки электронной медицинской карты субъекта исследования; Субъект – обследуемый на предмет выявления рака желудка и необходимости проведения дальнейшего дополнительного клинического обследования человек.
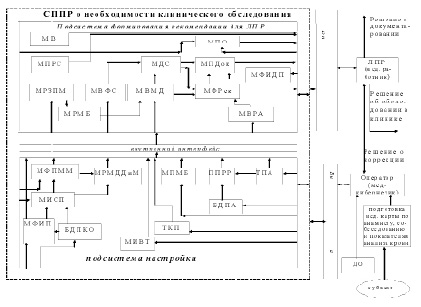
Рис. 1. Структура интеллектуальной системы поддержки принятия решения скрининг-диагностики рака желудка
Представленная интеллектуальная СППР состоит из двух подсистем: «Подсистема формирования рекомендаций для ЛПР» и «Подсистема настройки», взаимодействие которых осуществляется с помощью внутреннего интерфейса системы. Указанные подсистемы посредством внешнего интерфейса реализуют следующие целевые функции системы:
– первая формирует и сообщает ЛПР информацию рекомендательного характера о необходимости дальнейшего клинического обследования пациента;
– вторая осуществляет определение необходимых для нормального функционирования модулей «Подсистемы формирования рекомендаций для ЛПР» структур, параметров и условий.
«Подсистема настройки» включает в себя модули: МФППММ, МРМДДиМ, МПМБ, ППРР ТПА, МИСП, МФИП, БДКО, ТКПЮ, БДПА. «Подсистема формирования рекомендаций для ЛПР» включает в себя следующие: МРМБ, МВРА, МРЗПМ, МВФС, МВМД, МДС, МФРек, МДС, МФИДП, МПДок, МВ, МПРС, МПО. «Подсистема настройки» взаимодействует посредством дружественного интерфейса с оператором (врач-кибернетик), который под руководством ЛПР вводит в подсистему необходимую для этапа обучения информацию: формирует БДПК, вводит пороговые значения уровней мер доверия и уверенности.
Для признаков, сформированных по анализу обследуемого Q, на основании специфической информации и опыта экспертов-врачей, определяются риски по отношению к заболеванию раком желудка 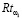 . На этапе обучения СППР формируются гибридные нечеткие решающие правила для оценки уверенности
. На этапе обучения СППР формируются гибридные нечеткие решающие правила для оценки уверенности  в классе
в классе 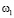 по значениям Q и
по значениям Q и 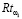 , вида:
, вида:
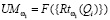 , (1)
, (1)
где 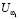 – уверенность в классе
– уверенность в классе 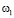 ; Qi – набор признаков, получаемых в ходе анализа ответов на опросник,
; Qi – набор признаков, получаемых в ходе анализа ответов на опросник, 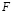 – функционал агрегации;
– функционал агрегации; 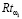 – показатели риска, получаемые из справочных общепризнанных источников.
– показатели риска, получаемые из справочных общепризнанных источников.
Для регулирования соотношений между количеством ошибок первого и второго родов на экспертном уровне выбираются величины двух порогов 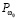 и
и 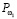 , алгоритм принимаемых решений по которым определяется табл. 1.
, алгоритм принимаемых решений по которым определяется табл. 1.
Таблица 1
Диагностические заключения относительно порогов 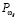
|
|
|
|
|
Идентификатор (№) ситуации |
Описание ситуации |
|
0 |
0 |
0 |
0 |
1 |
Дополнительное обследование |
|
0 |
0 |
0 |
1 |
2 |
Здоров – класс |
|
0 |
0 |
1 |
0 |
1 |
Дополнительное обследование |
|
0 |
1 |
0 |
0 |
3 |
Болен – класс |
|
1 |
0 |
0 |
0 |
1 |
Дополнительное обследование |
Таблица 2
Факторы риска заболевания раком желудка по показателям множества {Q}
|
группа NQg |
Группа показателей Qg |
Семантика показателя (вопроса в опроснике) |
Балл |
|
|
1 |
2 |
3 |
4 |
5 |
|
1 |
Половозрастной фактор |
Мужчины, 55 лет и старше Женщины, 60 лет и старше Мужчины моложе 55 лет Женщины моложе 60 лет |
1 1 0 0 |
FQ1 |
|
2 |
Страна проживания |
Япония, Центральная Америка, Восточная Европа, Южная Америка, Южная Европа, Китай Другие страны |
1 0 |
FQ2 |
|
3 |
Особенности питания |
Чрезмерное увлечение пищей: копченой, острой, соленой, жареной (пережаренной), консервированной пищей, длительно хранящимися продуктами, содержащими нитраты |
1 1 1 1 1 1 1 |
FQ3 |
|
4 |
Употребление алкоголя |
Злоупотребление |
0-10 |
FQ4 |
|
5 |
Курение |
Чрезмерное |
0-10 |
FQ5 |
|
6 |
Общее самочувствие |
Понижение аппетита Изменение пищевых пристрастий Постоянное повышение температуры Ощущение тяжести в животе после еды, тошнота и рвота, быстрая насыщаемость Желудочный дискомфорт Нарушение стула (поносы, запоры) Желудочно-кишечные кровотечения Опоясывающие боли Увеличение объема живота Похудение Общая слабость, снижение трудоспособности Побледнение покровов, их пастозность или отечность Психическая депрессия (потеря целесообразности труда, отчужденность, апатия) |
8 10 5 8 8 5 10 3 5 8 5 5 5 |
FQ6 |
|
7 |
Ранее перенесенные болезни |
Гастриты (с пониженной кислотностью), язвы и полипы желудка Операции на желудке Пернициозная (злокачественная) анемия Резекция желудка Неэпителиальные опухоли желудка Язвенная болезнь желудка Первичные и вторичные иммунодефицитные состояния Длительно существующее воспаление желудка Частичное удаление блуждающего нерва (ваготомия) |
5 6 10 8 10 5 6 4 6 |
FQ7 |
|
8 |
Болезнь Менетрие |
Гипертрофическая гастропатия |
0-1 |
FQ8 |
|
9 |
Вирусы и бактерии |
Наличие в организме бактерии Helicobacterpylon Вирус Эпштейн-Барр |
10 8 |
FQ9 |
|
10 |
Семейный анамнез |
Больные раком желудка близкие родственники |
0-5 |
FQ10 |
|
11 |
Характер ритма жизни |
Беспорядочный Напряженный Стрессовый |
0-5 0-5 0-10 |
FQ11 |
|
12 |
Недостаток физической активности |
0-5 |
FQ12 |
|
|
13 |
Дефициты |
Витамина В12 Витамина С Овощей и фруктов |
0-5 0-5 0-5 |
FQ13 |
|
14 |
Окружающая среда |
Работа с химическими веществами: металлическая пыль, отходы горной промышленности при разработке карьеров, камнерезанье, отработанное дизельное топливо, радон, асбест, никель, резина, минеральные масла Ионизирующее излучение |
10 8 |
FQ14 |
Анализ различных информационных источников (например, [6, 7, 8, 9] и мнений экспертов-медиков позволил сформировать множество показателей множества {Q}, осуществить их кластеризацию в группы по семантической нагрузке, определить баллы и составляющие влияния группы на 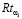 групповых показателями риска
групповых показателями риска 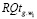 (g – номер семантической группы). Результаты выполненных исследований представлены в табл. 2.
(g – номер семантической группы). Результаты выполненных исследований представлены в табл. 2.
В табл. 2: Qg – группа показателей из {Q}; 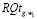 – составляющие влияния группы показателей Qg на риск возникновения и/или наличия рака желудка (
– составляющие влияния группы показателей Qg на риск возникновения и/или наличия рака желудка (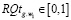 ); NQg – номер группы показателей Qg;
); NQg – номер группы показателей Qg; 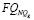 – частный показатель риска, определяющей значение
– частный показатель риска, определяющей значение 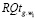 согласно заданной функции в зависимости от баллов показателей Qg в группе NQg.
согласно заданной функции в зависимости от баллов показателей Qg в группе NQg.
Для каждой функции 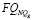 синтезируются правила ее вычисления, указанные в табл. 3. В таблице использованы следующие условные обозначения:
синтезируются правила ее вычисления, указанные в табл. 3. В таблице использованы следующие условные обозначения: 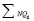 – сумма баллов в соответствующей группе NQg показателей из {Q}, если последних в группе более одного:
– сумма баллов в соответствующей группе NQg показателей из {Q}, если последних в группе более одного:
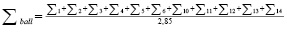 . (2)
. (2)
Для определения риска 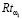 первоначально анализируются доминирующие группы показателей NQ7, NQ8, NQ9 и рассчитывается значение промежуточной переменной R:
первоначально анализируются доминирующие группы показателей NQ7, NQ8, NQ9 и рассчитывается значение промежуточной переменной R:
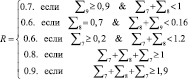 (3)
(3)
Таблица 3
Формулы определения частных рисков 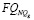
|
NQg |
Частный показатель риска |
|
1 |
для мужчин: |
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
6 |
|
|
7 |
|
|
8 |
|
|
9 |
|
|
10 |
|
|
11 |
|
|
12 |
|
|
13 |
|
|
14 |
|
Переменная R определяет риск наличия заболевания в условиях отсутствия субъективных показателей у обследуемого анамнезе пациента при наличии таковых в доминирующих группах.
Затем рассчитывается финальное значение риска 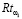 :
:
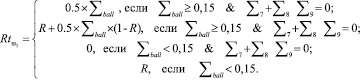 (4)
(4)
Таким образом, предлагаемая методика позволяет определить значение риска наличия рака желудка 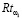 путем анализа анамнеза пациента без проведения лабораторных исследований или иных клинических исследований. Меру уверенности
путем анализа анамнеза пациента без проведения лабораторных исследований или иных клинических исследований. Меру уверенности 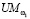 в правильности формируемой рекомендации предлагается вычислять по формуле (5) (функционал F в (1)):
в правильности формируемой рекомендации предлагается вычислять по формуле (5) (функционал F в (1)):
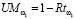 . (5)
. (5)
(С учетом популяционной специфики и степени строгости в выборе, рекомендации могут быть применены и более сложные структуры функционала F).
Выводы
Полученные функции и методика оценки степени риска заболевания раком желудка позволяют использовать их в базе знаний СППР для автоматического формирования рекомендаций по дальнейшему обследованию и вычисления мер доверия к ним.
Предлагаемый опросник, основанный на анализе различных информационных источников, позволяет достаточно адекватно оценивать состояние обследуемого в процессе реализации превентивной медицины в ходе массовой диспансеризации населения при наличии или отсутствии ряда ответов.
Разработанный математический аппарат оценки уверенности в адекватности формируемых СППР рекомендаций, применение интервалов пороговых значений мер уверенности позволяет формализовать идентификацию решающих диагностических правил рака желудка и спроектировать гибкую диагностическую автоматизированную систему, не требующую проведение клинических специализированных исследований и использует результаты ответов обследуемого на предлагаемые вопросы без первоначальной концентрации его внимания на семантику формируемого диагноза, – что позволяет существенным образом повысить объективность оценки полученной субъективной информации.


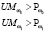
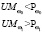
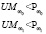
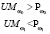
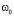
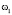
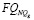
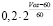 , для женщин:
, для женщин: 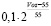 , где Voz – возраст в годах
, где Voz – возраст в годах