Хроническая обструктивная болезнь легких (ХОБЛ) – наиболее распространённое заболевание среди населения, с неуклонным прогрессирующим течением и ростом числа инвалидизирующих форм, что ассоциируется со значительным социально-экономическим ущербом не только для самих больных, но и членов их семей, общества в целом.
Патогенетической основой прогрессирующей обструкции дыхательных путей при ХОБЛ является хронический воспалительный процесс в дыхательных путях, когда в ответ на действие повреждающих факторов нарушается баланс между активностью про- и противовоспалительных цитокинов [1, 2, 10].
На протяжении долгого времени иммунологи придерживались парадигмы, предложенной T.R. Mossman и R.L. Coffman, в которой CD4+-клетки дифференцируются в два подкласса с реципрокными функциями и различным набором секретируемых цитокинов – Т-хелперы 1-го типа (Th1) и Т-хелперы 2-го типа (Th2) [11]. Открытые сравнительно недавно новые субпопуляции Т-лимфоцитов-хелперов 17-го типа (Th17) дают возможность пересмотреть теорию патогенеза ХОБЛ. Тh17-клетки продуцируют IL-17A, IL-17F и IL-21, которые привлекают нейтрофилы и активируют синтез антимикробных пептидов в клетках эпителия [7, 12, 13], тем самым нейтрофилы и эпителиальные клетки вовлекаются в реакции адаптивного иммунитета. Поэтому иммунный ответ, развивающийся по Th17-типу, наиболее важен на этапах тканевого воспаления и для защиты слизистых. Детальное изучение регуляторных медиаторов системной воспалительной реакции в развитии ХОБЛ создает предпосылки для более точного понимания тех биологических механизмов, которые лежат в основе патологического процесса. Это является важным фактором для последующего развития более эффективных методов контроля заболевания, разработки новых подходов диагностики и может оказаться концептуальной основой для новых направлений в противовоспалительной терапии.
Целью исследования явилась установление роли девиации Тh17 пути иммунного ответа в формировании воспаления при ХОБЛ разной степени тяжести.
Материалы и методы исследования
В исследовании на условиях добровольного информированного согласия участвовали 116 пациентов (74 мужчины и 42 женщины), средний возраст составил 57,5±4,8 года. Критериями разделения пациентов по группам была степень тяжести течения ХОБЛ (GOLD, 2011) [1]. По клинико-функциональным вариантам пациенты с ХОБЛ разделялись по группам: 36 человек (31 %) с легкой степенью тяжести, 52 человека (45 %) со средней степенью тяжести и 24 человека (24 %) с тяжелой степенью тяжести. На момент обследования пациенты не получали регулярной противовоспалительной терапии. Критериями исключения из исследования явилось наличие у пациентов острых инфекционных заболеваний, хронических заболеваний внутренних органов в фазе обострения, хронической сердечной недостаточности в стадии декомпенсации. В контрольную группу вошли 32 практически здоровых лиц (6 мужчин и 26 женщин), не курящих, с нормальной функцией внешнего дыхания, средний возраст – 42,0±3,4 года.
Заболевания бронхолегочной системы диагностировали на основании данных анамнеза, объективного осмотра, пикфлоуметрии, спирографии с выполнением бронхолитического теста (спирограф «FUKUDA”, Япония), результатов тестов mMRС и САТ, рентгенологического и лабораторного исследования. В соответствии с рекомендациями «Глобальной стратегии: диагностика, лечение и профилактика ХОБЛ» диагноз ХОБЛ выставляли при ОФВ/ФЖЕЛ < 0,70 [1]. По результатам спирометрии у пациентов с легкой степенью тяжести ХОБЛ постбронходилятационный показатель ОФВ1 составил 90,13±1,99 %. По результатам опроса у пациентов определялась одышка в 1 балл по шкале mMRС и 4 балла по тесту САТ. У пациентов со среднетяжелой степенью тяжести ХОБЛ показатель ОФВ1 составил 73,9±2,56 %. По результатам опроса у пациентов определялась одышка в 2 балла по шкале mMRС и 9 баллов по тесту САТ. У пациентов с тяжелой степенью тяжести ХОБЛ показатель ОФВ1 составил 48,6±1,76 %, по шкале одышки mMRС определялись более 2 баллов и по тесту САТ не менее 10 баллов.
Субпопуляции Th1- и Th17-лимфоцитов оценивали по уровню цитокинов в сыворотке крови (туморнекротизирующий фактор (TNF-a), интерлейкины (IL) IL-4, IL-6, IL-10, IL-17А) и интерферон гамма (IFN-γ) (тест-системы фирмы BD, USA) методом проточной цитометрии на цитометре BD FACScanto. Обработку данных проводили с использованием программы FCAP Array 3,0 (BD, USA). Уровень секреции трансформирующего фактора роста β1 (TFG-β1) и IL-21 в сыворотке крови определяли иммуноферментным методом (Genzyme diagnostics, USA).
Статистическую обработку данных проводили при помощи пакета прикладных программ «Statistica 6.0». Для выявления значимых различий сравниваемых показателей использовали U-критерий Манна-Уитни. Различия считались значимыми при р<0,05.
Результаты исследования и их обсуждение
В группе больных ХОБЛ легкой степени тяжести у 67 % пациентов выявлено увеличение концентрации TNF-α и IFN-γ и снижение уровня IL-4 по сравнению с контрольной группой (рис. 1). Высокая концентрация провоспалительных цитокинов (TNF-α, IFN-γ) свидетельствует о наличии воспалительного процесса у больных ХОБЛ легкой степени тяжести. Дефицит IL-4 и высокий уровень IFN-γ указывают на дифференцировку наивных Т-лимфоцитов по Th1-зависимому пути. У 12 больных (33 %) ХОБЛ легкой степени тяжести наблюдалось повышение уровня провоспалительных – IL-6, IL-17А и IL-21 и противовоспалительных цитокинов – IL-10, TGFβ1, снижение секреции IL-4 по сравнению с группой контроля (рис. 2). Это свидетельствует о формировании специфического цитокинового паттерна, приводящего к дифференцировке Т-хелперов 17 типа. Экспрессия IFN-γ и TNF-α у данных пациентов незначительно увеличивалась по сравнению с группой контроля, но статистически значимо отличалась только у больных дифференцируемых по Th1 пути иммунного ответа. Таким образом, у больных ХОБЛ легкой степени тяжести выявлено преобладание Th1 типа иммунного ответа.
В группе больных ХОБЛ средней степени тяжести Th1 путь иммунного ответа выявлен у 24 человек (46 %), который характеризовался снижением секреции IL-4, IL-21 и повышением продукции TNF-α и IFN-γ по сравнению с контрольной группой (рис. 1). У 28 больных (54 %) ХОБЛ средней степени тяжести установлена активация Th17 иммунного ответа, который поддерживался высокими значениями провоспалительных IL-6, IL-17А, IL-21 и противовоспалительных IL-10, TGF-β1 цитокинов (рис. 2). Следовательно, у больных ХОБЛ средней степени тяжести в равной мере выявлялась активация Th1 и Th17 клеточных путей.
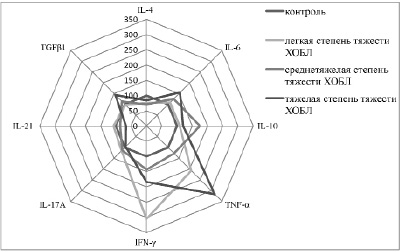
Рис. 1. Показатели цитокинового профиля по Th1 пути у больных ХОБЛ в зависимости от степени тяжести
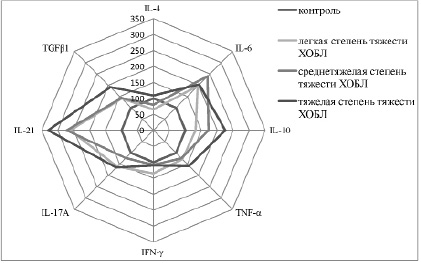
Рис. 2. Показатели цитокинового профиля по Th17 пути у больных ХОБЛ в зависимости от степени тяжести
Среди пациентов ХОБЛ с тяжелой степенью тяжести у 6 человек (28 %) выявлено снижение IL-4 и динамическое нарастание синтеза TNF-α и IFN-γ на фоне низких значений IL-17А, IL-21, что свидетельствует о поддержании Th1 типа иммунного ответа (рис. 1). У 18 больных (72 %) ХОБЛ с тяжелой степенью тяжести диагностировали максимальные значения провоспалительных цитокинов IL-6, IL-17А, IL-21 и противовоспалительных – IL-10, TGF-β1, что указывает на продуцирующую активацию Th17 лимфоцитов, играющих роль дирижера воспалительной реакции (рис. 2). Результаты исследования показали, что у больных ХОБЛ с тяжелой степенью тяжести выявлено преобладание иммунного ответа по Th17-типу, который регулирует дифференцировку Т-регуляторных клеток. Формирование специализированного фенотипа лимфоцитов Th17 детерминирует привлечение и активацию нейтрофилов, что играет важную роль на этапе разрешения воспаления [6, 13]. Исследования E. Volpe и соавт. показали, что TGF-β в сочетании с IL-6 индуцирует дифференцировку наивных Т-лимфоцитов периферической крови в Th17 [14]. В присутствии TGF-β1 и IL-6 популяция Th17-клеток усиливает экспрессию IL-10 наряду с IL-17А [4, 7]. IL-10, как противовоспалительный цитокин, помогает контролировать Th1 зависимые процессы через угнетение экспрессирующей активности клеток Th1 типа [3, 5, 8]. Кроме того, IL-21 продуцируется самими T-хелперами 17 типа и осуществляет регуляцию их функциональной активности по принципу положительной обратной связи [4, 9, 12]. Дифференцировка Th17 клеток подавляет формирование клонов Th1, и наоборот, продуцируемые Th1 лимфоцитами цитокины TNF-α и IFN-γ угнетают фенотипирование Th17 клеток и синтез IL-17А и IL-21.
Заключение. Результаты исследования свидетельствуют, что у пациентов с ХОБЛ разной степенью тяжести изменения баланса про- и противовоспалительных цитокинов характерны как для Th1-, так и для Th17-типов иммунного ответа. Разнообразие форм иммунного ответа достигается за счет активации различных клеток-эффекторов: ответ по Th1-типу связан с активацией макрофагов и выработкой IFN-γ; при девиации Тh17-типа иммунного ответа активируются нейтрофилы, эпителиальные клетки и синтез IL-17, IL-21. Важно подчеркнуть, что цитокины, продуцируемые Th17 клетками при утяжелении ХОБЛ подавляют дифференцировку Th1 клонов и формируют свой независимый иммунорегуляторный путь, лимитирующий функцию Th1 лимфоцитов. Возможно, что девиация Th-17 иммунного ответа при хронических заболеваниях органов дыхания играет компенсаторную роль для сдерживания активации провоспалительных механизмов иммунорегуляции. Таким образом, определенный тип иммунных нарушений при ХОБЛ диктует необходимость дальнейшего изучения роли адаптивных субпопуляций Т-клеток при тяжелом и осложненном течении ХОБЛ.

