Шизофрения – это заболевание неустановленной этиологии и патогенеза, протекающее с полиморфной симптоматикой и приводящее к особому дефекту личности [5]. В основе распространенной нейрохимической концепции патогенеза шизофрении лежит нарушение обмена в дофаминергической и глутаматергической системах. Специфических тестов (биомаркеров) для диагностики шизофрении в настоящее время не существует [1].
При шизофрении наблюдается активация деструктивных процессов, что может проявиться в изменении внутренних механизмов гомеостаза и в свою очередь отрицательно отражается на состоянии организма. Деструктивные процессы, лежащие в основе неспецифического синдрома эндогенной интоксикации, как правило, связаны с активацией окислительного стресса и сопровождаются нарушениями структуры и функции мембран и в целом рассматриваются как реакции «метаболического полома» [6, 10]. Изучение изменения количества и спектра фракций МСМ в сыворотке крови пациентов с психическими и неврологическими расстройствами позволяет расширить представление о роли и функции эндогенной интоксикации в патогенезе этих состояний и показать их клиническое и диагностическое значение [2].
При ряде заболеваний выявляются антиядерные антитела к ДНК. Патогенетическое и клиническое значение этих антител (АТ) изучено недостаточно [3]. Антинуклеарные антитела – гетерогенная группа аутоантител к нуклеопротеидам, гистонам и негистоновым белкам клеточного ядра. Уровни антинуклеарных антител различаются в зависимости от индивидуальной иммунореактивности и характера заболевания. Необходимо учитывать то, что аутоиммунный ответ может отличаться на нативную ДНК (dsDNA) и денатурированную (ssDNA).
Особое внимание в биологических исследованиях психических расстройств уделяют гормонам гипоталямо-гипофизано-надпочечниковой оси и, в частности, кортизолу. Повышенную концентрацию эндогенного и экзогенного кортизола в организме человека связывают с повышенным риском развития психозов [9]. Нейростероиды дегидроэпиандростерон и его сульфат (ДГЭА-С) воздействуют на возбудимость нейронов и пластичность, обладают нейропротекторными свойствами и могут быть вовлечены в патофизиологические процессы при шизофрении.
Глутамат, являясь возбуждающей аминокислотой пирамидного тракта и интернейронов, в определенных условиях может становиться эксайтотоксином. Эксайтотоксичность – цитотоксичность, свойственная возбуждающим нейротрансмиттерам. В настоящее время считается, что в механизмах гибели нейронов при ряде психических и нейродегенеративных заболеваниях принимают участие процессы эксайтотоксичности.
Целью работы является выявление и исследование биологических маркеров деструктивных процессов в сыворотке крови у больных шизофренией.
Материалы и методы исследования
Было проведено комплексное клинико-биологическое обследование 155 больных шизофренией (диагноз F20 согласно МКБ-10), проходивших курс лечения в психиатрическом стационаре. Включение пациентов в исследование проводилось с учетом этических норм и в соответствии с требованиям Хельсинской декларации Всемирной медицинской ассоциации об этических принципах проведения медицинских исследований с участием людей в качестве субъектов (2000 г.). Группу сравнения для биохимических исследований составили 50 психически и соматически практически здоровых лиц, соответствующих по полу и возрасту обследуемым пациентам.
В качестве исследуемого материала для биохимических исследований использовалась сыворотка крови, получаемая по стандартной методике отделением эритроцитов центрифугированием. Оценку параметров эндогенной интоксикации у обследуемых лиц проводили по спектру молекул средней массы с помощью скрининг-метода в нашей модификации [2]. Данный метод позволяет выделить три фракции МСМ, регистрируемые при различных длинах волн: при 230 нм – нуклеарная фракция (белки-гистоны, продукты разрушения ДНК); при 254 нм – токсическая фракция (гидрофобные токсины, продукты неполного распада белков); при 280 нм – ароматическая фракция (ароматические аминокислоты). Результаты представлены в условных единицах (экстинкции) с вычислением нескольких коэффициентов: коэффициент ароматичности (КА = Е230/Е280), коэффициент распределения (КР = Е280/Е254) и пептидарно-нуклеарный коэффициент (ПНК = Е230/Е254).
Для количественного определения иммуноглобулина G к dsДНК и ssДНК использовали наборы реагентов для иммуноферментного анализа «Векто-dsДНК-IgG» и «Векто-ssДНК-IgG» (ЗАО «Вектор-Бест», Россия). Концентрацию кортизола и ДГЭА-С определяли с использованием ИФА-наборы реагентов СтероидИФА-кортизол-01 и СтероидИФА-ДГЭА-сульфат («АлкорБио», Россия) соответственно. Уровень глутамата определяли спектрофотометрическим методом с использованием набора Glutamate Assay Kitt (BioVision, США).
Статистическая обработка результатов проводилась с помощью программы SPSS 20.0, для Windows. Выборки проверялись на нормальность распределения по критерию Шапиро-Уилка. Достоверность различий определялась по t-критерию Стьюдента при нормальном распределении для независимых выборок с вычислением среднего и ошибки среднего. Для независимых выборок при распределении, отличающемся от нормального, достоверность различий определяли по U-критерию Манна-Уитни с вычислением медианы и квартилей. Различия считали достоверными при степени значимости р < 0,05.
Результаты исследования и их обсуждение
У больных шизофренией на фоне выраженной клинической симптоматики было обнаружено достоверное увеличение токсической фракции и снижение коэффициента распределения (Е254 = 0,321 ± ± 0,048 усл.ед., p = 0,005; КР = 0,909 ± ± 0,013, p < 0,001) по сравнению с группой контроля (Е254 = 0,287 ± 0,015 усл.ед., КР = 1,235 ± 0,103) (рис. 1, 2).
Выявлено достоверное повышение содержания нуклеарной фракции, коэффициента ароматичности, как и самой ароматичекской фракции. Изменение спектра средних молекул в сторону нуклеарной фракции связано с увеличением в крови остатков нуклеиновых кислот, что может быть следствием усиления апоптоза клеток крови при шизофрении.
Физиологические значения концентрации антител к ДНК здоровых лиц не превышают 25 МЕ/мл, значения больных были разделены на два диапазона: до 25 МЕ/мл и выше. В группе больных шизофренией наблюдается повышенное содержание АТ к денатурированной ДНК (30,278 ± 3,457 МЕ/мл) по сравнению с физиологической нормой (< 25 МЕ/мл). Уровень АТ к нативной ДНК практически не отличается от значений здоровых лиц (27,622 ± 3,788 МЕ/мл). У 28 % больных наблюдается повышенный уровень АТ к dsDNA, у 72 % их содержание в пределах физиологической нормы. АТ к ssDNA повышены у 40 % пациентов (рис. 3).
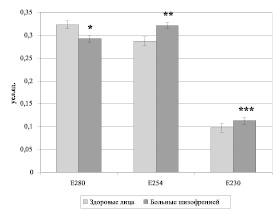
Рис. 1. Спектр молекул средней массы у больных шизофренией и здоровых лиц (М ± m). Примечание: Е280 – коэффициент экстинции при длине волне 280 нм – ароматическая фракция; Е254 – коэффициент экстинции при длине волне 254 нм – токсическая фракция; Е230 – коэффициент экстинции при длине волне 230 нм – нуклеарная фракция.* – р = 0,029, ** – р = 0,005, *** – р = 0,02 – уровень статистически значимых различий при сравнении показателей пациентов и контрольной группы
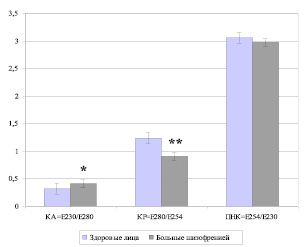
Рис. 2. Спектр молекул средней массы в пересчёте на коэффициенты у больных шизофренией и здоровых лиц (М ± m). Примечание: КА – коэффициент ароматичности; КР – коэффициент распределения; ПНК – пептидарно-нуклеарный коэффициент. * – р = 0,01, ** – р < 0,0001 – уровень статистически значимых различий при сравнении показателей пациентов и контрольной группы
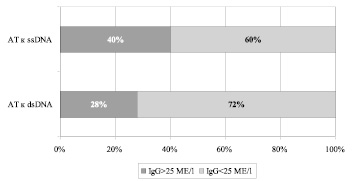
Рис. 3. Распределение пациентов ( %) в зависимости от уровня антиядерных антител к денатурированной и нативной ДНК относительно физиологической нормы (25 МЕ/l)
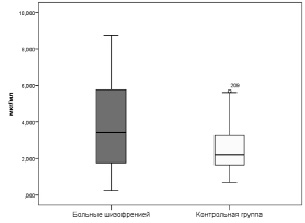
Рис. 4. Концентрация ДГЭА-С (мкг/мл) в сыворотке крови больных шизофренией и здоровых лиц (Me [Q1;Q3]). Примечание: р = 0,015 – уровень статистической значимости различий при сравнении показателей пациентов и контрольной группы
В результате проведенного иммуноферментного анализа было выявлено достоверное (р = 0,048) повышение уровня кортизола в сыворотке крови больных шизофренией (610,27 ± 15,58 нмоль/л) по сравнению с группой контроля (540,73 ± 22,94 нмоль/л). Аналогичная ситуация наблюдается относительно концентрации ДГЭА-С в сыворотке крови (рис.4). Было обнаружено достоверное (р = 0,015) повышение содержания нейростероида у пациентов (3,426 [1,749; 5,788] мкг/мл), сравнивая со значением здоровых лиц (2,199 [1,619; 3,273] мкг/мл).
В результате спектрофотометрического исследования было обнаружено статистически значимое повышение уровня глутамата у больных шизофрений (21,106 ± 0,428 нмоль/мкл) относительно содержания этой аминокислоты у лиц контрольной группы (10,566 ± 0,507) (рис. 5).
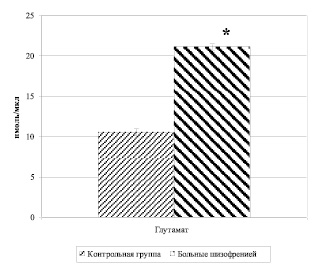
Рис. 5. Концентрация глутумата (нмоль/мкл) в сыворотке крови у больных шизофренией и здоровых лиц (М ± m). Примечание: * – р < 0,0001 – уровень статистической значимости различий при сравнении показателей между собой
Увеличение содержания МСМ у пациентов находится в соответствии с изменением уровня антител к ДНК. Повышение уровня МСМ и содержания АТ к ДНК у больных шизофренией, вероятно, обусловлено усилением их образования в тканях и патологией их элиминации из организма.
Высокий уровень кортизола у больных шизофренией свидетельствует об активации гипоталамо-гипофизарно-надпочечниковой оси, как одного из регуляторов стресс-системы организма. Гиперсекреция кортизола вызывает сдвиг метаболизма в сторону катаболических процессов, т.е. процессы распада и высвобождения энергии начинают преобладать над анаболическими. В тоже время, выявлено повышение концентрации ДГЭА-С, что вероятно является компенсаторной реакцией организма. Повышение концентрации кортизола усугубляет нарушения дофаминергической системы, наблюдаемые при шизофрении, особенно на фоне длительной антипсихотической терапии. Применение психотропных соединений прямо или опосредованно приводит к изменению концентрации гормонов в организме пациентов и основных видов обмена веществ и, как следствие этого, к сдвигу в деятельности ключевых энзиматических систем.
Нарушение глутаматергической трансмиссии считается ключевым компонентом патогенеза шизофрении [8, 7]. Согласно теории экстайтотоксичности, происходит избыточный выброс в постсинаптическую щель возбуждающих нейромедиаторов, что приводит к гиперактивации постсинаптических глутаматных рецепторов и, как следствие, к нарушению проницаемости ионных каналов. Избыточное накопление внутриклеточного кальция запускает каскад реакций с активацией протеолитических ферментов и разрушением клеточных структур, ведет к увеличению синтеза оксида азота, возрастанию ПОЛ с последующим развитием окислительного стресса, нарушением синтеза нейротрофических факторов и к апоптозу [4].
Заключение
Выявление комплекса биомаркеров, которые связаны с развитием деструктивных процессов или недостаточностью функционирования нейропротективных систем (нейростероидов и нейротрофинов) может внести вклад в понимание метаболических нарушений, связанных с патогенезом заболевания и позволит использовать выявленные особенности для коррекции лечения и подбора соответствующей терапии с точки зрения персонализированного подхода к пациентам.
Работа выполнена при поддержке гранта РНФ № 14-15-00480 «Поиск ключевых биомаркеров патогенеза социально значимых эндогенных психических расстройств».

