Хронический посттравматический остеомиелит продолжает оставаться актуальной медико-биологической и социальной проблемой. По данным современных исследований установлено, что при хронических формах заболеваний микробной этиологиив в организме формируются биопленка [1, 2]. Наиболее часто выделяемыми возбудителями у больных хроническим остеомиелитом являются Pseudomonas aeruginosa и Staphylococcus aureus. Формирование биопленок с участием этих микроорганизмов может играть решающую роль в патогенезе остеомиелита. Подавляющее большинство исследований относится к изучению моновидовых биопленок, с использованием светового микроскопа и/или спектрофотометра. Вопросы структурно-функциональных особенностей моновидовых биопленок и межмикробного взаимодействия в многовидовых биопленках остаются недостаточно изученными. Сканирующая электронная микроскопия, в отличие от традиционных методов исследования биопленок, позволяет использовать более широкий диапазон увеличений, исследовать рельеф объекта, а не только клетки поверхностного слоя [3, 4].
Цель исследования – определить морфологические особенности биопленки бактерий, выделенных у пациентов с хроническим остеомиелитом, с помощью сканирующего электронного микроскопа.
Материалы и методы исследования
Объектом исследования служили микроорганизмы, выделенные из зоны повреждения кости пациентов с хроническим гнойно-воспалительным процессом в кости, проходивших лечение в «Российском научном центре «Восстановительная травматология и ортопедия» им. акад. Г. А. Илизарова». В исследование были включены штаммы P. aeruginosa, S. aureus и смешанная культура, полученная in vitro из этих же штаммов. Видовая принадлежность штаммов установлена с использованием бактериологического анализатора и микротест систем фирмы «BioMerieux» (Франция). Биопленку получали культивированием бактерий на подложке стерилизованной полистироловой ячейки блистерной упаковки диаметром 3 мм с перфорациями по всему диаметру, погруженной в суспензию микроорганизмов в жидкой питательной среде (ГРМ-агар) в течение суток [5]. После культивирования образец с микроорганизмами на подложке упаковки фиксировали в смеси 2 %-х растворов параформальдегида и глутаральдегида на фосфатном буфере (рН 7,4) с добавлением 0,1 % пикриновой кислоты при температуре 4 °С. Затем промывали в фосфатном буфере и дистиллированной воде, используя фильтровальную бумагу для удаления раствора через отверстия в ячейке. Обезвоживали в этиловом спирте возрастающей концентрации, пропитывали в камфене (С10Н16) при температуре 60 °С. Далее образцы высушивали на воздухе до полной возгонки камфена при комнатной температуре [5]. Монтировали ячейки с бактериями на держатель образца. Затем напыляли серебром в ионном напылителе «IB-6» (JEOL, Япония) и изучали в сканирующем электронном микроскопе «JSM-840» (JEOL, Япония) при инструментальном увеличении 2500-10000 во вторичных электронах с ускоряющим напряжением 20 keV.
Результаты исследования и их обсуждение
Через 24 ч. культивирования выявлены микроорганизмы палочковидной (P. aeruginosa) и кокковидной формы (S. aureus), объединенные секретированными ими полимерами и адгезированными к поверхности ячейки (рис. 1).
Клетки Staphylococcus располагались отдельными группами в форме неправильных скоплений (по 4–30 клеток), в том числе напоминающих виноградную гроздь, однослойных цепочек, и редко, одиночных клеток (рисунок, а). Отмечен тесный непосредственный контакт между клетками. Обнаружены единичные двухслойные скопления клеток, объединенные матриксом. Отмечены участки ячейки свободные от бактерий.


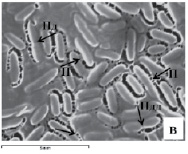

Сканограммы штаммов P. aeruginosa и S. aureus выделенных из зоны повреждения кости у пациентов с хроническим остеомиелитом. а) S – одиночные клетки S. aureus, В – скопление клеток S. aureus «виноградная гроздь», Ц – скопление клеток S. aureus в виде цепочки, П – поверхность ячейки, увеличение 2500; б) Р – P. aeruginosa, М – матрикс, П – поверхность ячейки, увеличение 3000; в) П – перетяжка, Пд – перетяжка делящейся клетки P.aeruginosa, Пдд – перетяжка поделившейся клетки P. Аeruginosa, увеличение 10000; г) S – S. aureus, Р – P. aeruginosa, М – матрикс, увеличение 5000. Фиксация в смеси растворов параформальдегида и глутаральдегида на фосфатном буфере (рН 7,4)
Клетки P. аeruginosa располагались под различным углом относительно друг друга, образуя сплошной монослой из палочковидных клеток, погруженных в матрикс (рисунок, б). Между клетками выявлены как непосредственные контакты, так и матрикс – опосредованные взаимосвязи. При инструментальном увеличении 10000 выявлены отдельные клетки, которые соединялись между собой перетяжками из структур матрикса, связывающие бактерии друг с другом (рисунок, в). Выявлены P. aeruginosa, различные по форме и размеру, а также овальные мелкие клетки, соединенные перетяжкой, характерной для делящихся бинарным путем палочковидных бактерий.
В смешанной культуре P. aeruginosa + S. aureus отмечено количественное преобладание палочковидных форм над кокковидными (рисунок, г). Обнаружена трехмерная структура, состоящая из нескольких слоев микробных клеток. Палочковидные бактерии, адгезированные к поверхности ячейки, погруженные в матрикс, располагались монослоем. На поверхности этого монослоя выявлены отдельно расположенные клетки P. aeruginosa и группы клеток S. aureus с преобладанием последних.
Обсуждение полученных данных. Анализ полученных данных позволил выявить морфологические особенности ранних моновидовых биопленок золотистого стафилококка и синегнойной палочки из остеомиелитического очага у пациентов с хроническим гнойно-воспалительным процессом. Отмеченное преобладание палочковидных форм на этапе адгезии микроорганизмов к субстрату позволяет предположить, что в условиях in vitro адгезия планктонных форм к поверхности полистироловой ячейки блистерной упаковки более выражена у штамма P. aeruginosa. Аналогичные данные были получены при исследовании биопленкообразующей способности этого возбудителя другими методами [6].
В смешанной культуре (P. Aeruginosa + S. aureus) выявленное в биопленке преобладание P. aeruginosa, формирующих монослой, вероятно, обусловлено высокими пленкообразующими свойствами штаммов рода Pseudomonas. В практической медицине при многократном исследовании пациентов традиционными бактериологическими методами нередко отмечается смена одного возбудителя другим. У больных хроническим остеомиелитом известны факты выделения S. aureus при первом заборе материала и P. aeruginosa (или ассоциация бактерий) – при повторном заборе [7]. Формирование трехмерной структуры смешанной бактериальной культурой свидетельствует об активизации процесса пленкообразования бактериями. Межвидовые взаимосвязи в биопленках, образованных различными видами бактерий, требуют дальнейшего изучения. По нашему мнению, в лабораторной практике при проведении исследования бактериальной инфекции у пациентов с хроническим остеомиелитом необходимо учитывать особенности начальных этапов формирования биопленки и межвидовые взаимоотношения микробиоценоза в смешанной культуре.
Таким образом, штаммы родов Pseudomonas и Staphylococcus, выделенные у пациентов с хроническим остеомиелитом, в условиях in vitro через 24 ч культивирования формируют бактериальную пленку на полистироловой поверхности с выраженными видовыми отличиями. Штаммы рода P. aeruginosa обладают высокими пленкообразующими свойствами. Смешанная культура (P. Aeruginosa + S. aureus) образует трехмерную структуру биопленки через 24 ч.

