В современной практике золотым стандартом среди трансплантатов и искусственных материалов, замещающих костную ткань, является аутологичный костный трансплантат.
Практическое применение собственной костной ткани пациента сопряжено с ограниченным количеством данного заместителя, а забор костной ткани нередко сопровождается осложнениями, в том числе и частичной резорбции в имплантационном ложе, что может привести к их усталостному или перестроечному разрушению [3]. Применение аллогенного костного трансплантата сопровождается опасностью развития реакции его отторжения организмом донора и передачи через материал патогенных агентов [4].
Технологии тканевой инженерии позволяют избежать указанных выше рисков. К ним относится замещение костного дефекта синтетическими и природными биоматериалами, способствующими миграции, адгезии и пролиферации клеток, синтезирующих межклеточное вещество костной ткани. Наиболее перспективными являются биокерамические материалы. Их главное преимущество перед другими материалами (металлы, полимеры) – превосходная биосовместимость [2; 5].
Практическое применение биокерамики на основе гидрооксиаппатита, ограничено низкой прочности на сжатие, приводящей к их разрушению в нагружаемых локализациях [8; 6; 9; 10]. Инъекционные костные цементы на основе полиметилметакрилата, фосфатов кальция, инкапсулируются [7]. Алюмооксидная биокерамика физическими свойствами значительно превосходит биокерамику на основе гидроксиапатита [1; 5].
Таблица 1
Форма и прочность исследуемых гранул
|
Гранулированные заместители, их размер, диаметр пор и вид пористости. |
Биокерамические алюмоксидные цилиндры с диаметром 1 мм. Сквозная пора с диаметром 500 μm. |
Биокерамические гранулы на основе кораллового гидрокисапатита размерами 0,5÷1 мм. Средний диаметр пор 400 μm, сквозная пористость (поры сообщаются между собой). |
|
Прочность на сжатие |
Не менее 300 МПа |
12 МПа |
|
Сокращенное обозначение |
Al2O3 |
CaP |
В литературе крайне мало сведений относительно способности алюмоксидных биокерамических гранул к остеоинтеграции, а также их применения для замещения дефектов костной ткани в нагружаемых локализациях скелета.
Цель исследования: изучить остеоинтеграцию конгломерата алюмооксидных и гидрооксиапатитных гранул, а также процесс роста и распространения окружающих тканей в пространство между гранулами в различных частях дефекта тела позвонка.
Материалы и методы исследования
Эксперимент проведен на 6 беспородных собаках весом от 15 до 18 кг. Выполнялась имплантация синтетических пластических гранул в тела поясничных позвонков лабораторных животных. Применены материалы представлены в табл. 1.
Как Al2O3 так и гранулы CaP имплантировались каждому животному в смежные позвонки.
Послеоперационное наблюдение проводилось в течение 6 месяцев. По истечению указанного срока животные выводились из эксперимента, после чего осуществлялся забор материалов и их подготовка к морфологическому исследованию. Из забранных материалов сформированы две группы препаратов по 6 образцов с одним видом пластического материала: в группе 1 имплантатами служили гранулы Al2O3, в группе 2 – гранулы CaP.
Хирургическая техника
Операция проводилась под общей анастезией. Осуществлялся доступ к поясничным позвонкам. В каудальной части тела нижележащего позвонка на вентролатеральной поверхности слева сверлом диаметром 5 мм в направлении спереди назад и от периферии к центру формировался цилиндрический дефект костной ткани, слепо заканчивающийся в губчатом веществе тела позвонка глубиной примерно 6 мм. Дефект заполнялся пластическим материалом CaP. Аналогичным образом в краниальной части того же тела позвонка на вентролатеральной поверхности слева формировался дефект с теми же размерами, который замещался пластическим материалом Al2O3. Осуществлялся гемостаз по ходу операции, послойно накладывались швы на рану.
Подготовка материалов и морфологические методы исследования
После забор материала и подготовленные препараты с имплантатами были анализированы на сканирующем электронном микроскопе Carl Zeiss EVO50 (Carl Zeiss AG, Германия). Структурные исследование проводились при ускоряющем напряжении 5 кВ в режиме регистрации вторичных электронов.
На всех полученных во время электронной микроскопии микрофотографиях оценивались две зоны поверхности распила препарата в месте их имплантации – периферическая и центральная. Схема распределения зон приведена на рис. 1. Каждая зона разделена на 8 равных секторов. В каждом секторе проводилась оценка морфологических данных следующим образом: если между гранулами пространство, незаполненной ни трабекулами костной такни, ни волокнами соединительной ткани, то данному сектору балл не присваивался; если между гранулами отмечалось врастание волокон соединительной ткани, сектору присваивался 1 балл, а в случае врастания костной ткани – 2 балла. Затем баллы всех секторов каждой зоны суммировались, а полученный результат учитывался при статистической обработке данных.
Результаты исследования и их обсуждение
При проведении экспериментов во время наблюдения за животными в послеоперационном периоде осложнений не было отмечено.
Результаты электронной микроскопии
На микрофотографиях плоскости распила препаратов через зону имплантации в группе 1 отмечался конгломерат алюмооксидных гранул Al2O3 (рис. 2). Выявлено врастание новообразованной костной ткани в пространство между гранулами в периферической зоне, где также наблюдался прямой контакт костной ткани с их поверхностью Пространство между гранулами всегда было заполнено волокнами соединительной ткани, которая также нарастала на их поверхность.
В отличие от предыдущей группы, где контакт костной ткани и пластических гранул в периферической зоне конгломерата отмечался во всех препаратах, в группе 2, где были имплантированы гранулы СaP, только в 3 препаратах из 6 наблюдали аналогичные результаты. В оставшихся препаратах отмечалась массивная соединительнотканная капсула, которая отделяла гранулы от новообразованной костной ткани. Во всех препаратах в центральной зоне отмечалась пустая полость, в которой свободно располагались гранулы CaP.
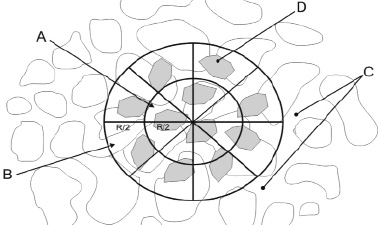
Рис. 1. Схема поверхности распила тела позвонка в месте имплантации конгломерата гранул (D) с обозначением границ его периферической (A) и центральной (B) зон. С – трабекулы костной ткани
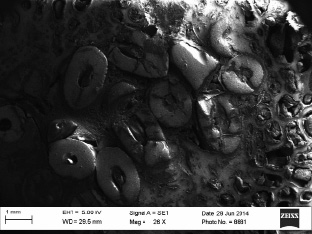
Рис. 2. Электронная микрофотография поверхности распила тела позвонка в зоне имплантации конгломерата гранул Al2O3 спустя 6 месяцев после операции. Увеличение в 3 раз: отмечается врастание новообразованной костной ткани в пространство между гранулами в периферической зоне
Результаты бальной оценки полученных микрофотографий приведены в табл. 2.
Проведено тестирования нормальности распределения в сравниваемых выборка. Гипотеза о нормальности распределения отвергалась, если достоверность критерия Shapiro-Wilks (SW-W и p на гистограммах) была меньше целевого уровня α (0,05).
Баллы, полученные при оценке периферической и центральной зон конгломератов в группах, статистически достоверно не различались (табл. 3, 4).
Таблица 2
Результаты бальной оценки микрофотографий на предмет наличия остеоинтеграции имплантированных гранул в группах
|
Группа |
Номер препарата |
Периферическая зона, бб |
Центральная зона, бб |
|
1 |
31 AL |
16 |
8 |
|
32 AL |
16 |
8 |
|
|
30 AL |
9 |
6 |
|
|
34 AL |
13 |
13 |
|
|
35 Al |
14 |
11 |
|
|
36 Al |
12 |
13 |
|
|
2 |
31 CaP |
13 |
10 |
|
32 CaP |
12 |
8 |
|
|
30 CaP |
14 |
14 |
|
|
34 CaP |
15 |
13 |
|
|
35 CaP |
12 |
0 |
|
|
36 CaP |
8 |
0 |
Таблица 3
Достоверность различий при сравнении баллов, полученных при оценке периферической зоны конгломератов на микрофотографиях во второй серии экспериментов
|
Группа 1 |
|
|
Группа 2 |
pA = 0,511 pM = 0,423 |
Примечание. pA – вероятность ошибки определенная методом 1-way ANOVA; pM – аналогичное значение, полученное при статистическом анализе с применением U-критерия Манна-Уитни.
Таблица 4
Достоверность различий при сравнении баллов, полученных при оценке центральной зоны конгломератов на микрофотографиях во второй серии экспериментов
|
Группа 1 |
|
|
Группа 2 |
pA = 0,423 pM = 0,749 |
Примечание. pA – вероятность ошибки определенная методом 1-way ANOVA; pM – аналогичное значение, полученное при статистическом анализе с применением U-критерия Манна-Уитни.
Заключение
Таким образом, в опытной группе 1 спустя 6 месяцев после имплантации конгломерата алюмооксидных гранул со сквозной порой в месте дефекта губчатой костной ткани тела позвонка поясничного отдела позвоночника беспородной собаки в периферической зоне конгломерата отмечается проникновение новообразованной костной ткани в пространство между гранулами с прямым контактом с их поверхностью, однако в центральной зоне конгломерата отмечается только врастание волокон соединительной ткани, которая заполняет все свободное пространство между ними. Изучаемые алюмооксидные биокерамические гранулы в отношении интеграции с окружающей костной тканью в эксперименте показали лучшие результаты, чем биокерамические гранулы на основе кораллового гидроксиапатита, у которых не отмечено заполнение полостей в центральной зоне конгломератов.

