Известно, что эмоциональный стресс является ведущим фактором, провоцирующим развитие сердечнососудистых заболеваний [5].
Индивидуальная чувствительность к стрессорным нагрузкам существенно различается [9]. Выявлены особенности оксидативно-антиоксидантного статуса тканей головного мозга крыс с разной прогностической устойчивостью к развитию отрицательных последствий стрессорных воздействий [2]. Продемонстрирована специфика действия биологически активных веществ, в том числе цитокинов, на состояние органов-маркеров стресса у животных с различными характеристиками поведения [3]. Кроме этого, показаны особенности вовлечения структур головного мозга в реализацию эффектов эндогенных соединений на системную организацию физиологических функций у предрасположенных и устойчивых к стрессу особей [4]. Животные с различной устойчивостью к стрессу различаются особенностями электрической активности мозга [6]. Известно, что устойчивость организма к стрессорным нагрузкам зависит от индивидуальных различий кортикостерона в плазме крови [8]. Однако механизмы индивидуальной устойчивости к стрессу остаются во многом неизученными. Обнаружено, что она зависит от определенных генетических факторов и неблагоприятных жизненных обстоятельств в детском и взрослом возрасте [7]. Недостаточно изученными являются параметры изменения показателей гемодинамики в процессе развития стрессовых реакций. Целью исследования стало изучение взаимосвязи между показателями динамики АД и ЧСС и разным уровнем кортикостерона крови крыс при стрессорной нагрузке.
Материалы и методы исследования
В работе были использованы 20 крыс самцов линии Вистар массой 280–320 г. Животных содержали в условиях свободного доступа к пище и воде, эксперименты проводили в соответствии с требованиями приказа № 267 МЗ РФ (19.06.2003 г.), а также с «Правилами проведения работ с использованием экспериментальных животных» (НИИ нормальной физиологии им. П.К. Анохина, протокол №1 от 03.09.2005 г.).
Первый забор крови из хвостовой вены крыс осуществляли с использованием кратковременной эфирной анестезии. Плазму отделяли центрифугированием (3000 об/мин в течение 3 мин.) и хранили при – 80 °С. Через двое суток животных помещали в условия конфликтной ситуации, вызывающей у них стрессорное состояние. Ее моделировали с помощью трехчасовой иммобилизации в тесных пеналах. В течение этого времени осуществляли постоянный мониторинг АД и ЧСС с помощью неинвазивного метода на установке TSE Non-Invasive BloodPressure Monitoring System «Fully-Automated» (Germany). При этом регистрировали систолическое, диастолическое и среднее ((2(АДд)+АДс)/3, где АДд – это диастолическое давление, а АДс – систолическое давление) давление крови, ЧСС с интервалом в 1 час. После стрессорной нагрузки проводили повторный забор крови при декапитации животных. Исследование уровня кортикостерона в плазме крови в контроле и после стресса проводили методом ИФА с использованием тест-системы «IDS Corticosterone EIA» (Великобритания) на ИФА ридере Multiscan EX (Thermo Fisher Scientific Inc., USA) в соответствии с протоколом производителя. Для проверки гипотезы о различии независимых выборок использовали непараметрические методы статистического анализа,U-критерий Манна-Уитни и коэффициент корреляции Спирмена.
Результаты исследования и их обсуждение
Животные предварительно были разделены на группы с исходно высоким (средняя концентрация гормона в данной группе 190 ± 73 нг/мл) и низким (408 ± 114 нг/мл) уровнем кортикостерона в контрольных не стрессовых условиях. Оказалось, что группы крыс с высоким и низким исходным уровнем кортикостерона достоверно не различались по показателям АД и ЧСС в исходных состояниях. Поэтому для дальнейшего изучения связи показателей работы сердечнососудистой системы с уровнем кортикостерона животные были разделены на две другие группы в зависимости от высокого и низкого уровня кортикостерона после трехчасового иммобилизационного стресса. Первая группа животных (9 крыс) характеризовались высоким уровнем кортикостерона в плазме крови после стресса – 655 ± 48 нг/мл), вторая – низкой концентрацией (11 крыс) – 325 ± 20 нг/мл. Две выделенные нами группы крыс достоверно различались по уровню этого гормона (р < 0,00001). Отметим, что хотя, как известно, стрессорная нагрузка вызывает достоверное увеличение уровня кортикостерона в плазме крови у крыс [8], у шести животных был обнаружен противоположный эффект – уменьшение уровня кортикостерона в плазме крови. Средняя концентрация кортикостерона у животных в обычных условиях содержания составила 299 ± 34 нг/мл, а после стрессорной нагрузки средний по всем животным уровень кортикостерона достоверно (p < 0,05) возрос до 473 ± 45 нг/мл. Мы не обнаружили корреляции между уровнем этого гормона до и после стресса у отдельных крыс (коэффициент корреляции Спирмена – 0,14).
У группы крыс с высоким уровнем кортикостерона после первого часа иммобилизации систолическое давление у оказалось достоверно (р < 0,005) ниже (189,4 ± 6,0 мм рт.ст.), чем у особей с низким уровнем кортикостерона (215,5 ± 4,3 мм рт.ст.) (рис. 1). При этом средние значения систолического давления за все три часа стрессорной нагрузки отличались менее достоверно (р < 0,05), чем показатели в течение первого часа иммобилизации, они составили 198,3 ± 3,6 мм рт.ст. и 211,6 ± 3,2 мм рт.ст. соответственно.
Отмечена тенденция к большему значению величины диастолического АД у группы животных с высоким уровнем кортикостерона после стрессорной нагрузки. Величина диастолического давления в течение первого часа иммобилизации составила 108,1 ± 6,2 мм рт.ст. у крыс с низким и 118,4 ± 7,4 мм рт.ст. у животных с высоким уровнем кортикостерона после иммобилизации (рис. 1). При этом, как и в случае систолического АД, средние значения наиболее различались в течение первого часа иммобилизации, а в последующие два часа стресса отличия между группами стирались.
Величины среднего АД достоверно не различались между группами крыс с высоким и низким уровнем кортикостерона ни в первый час, ни в последующие два часа иммобилизации. В первый час стрессорной нагрузки его средняя величина у группы крыс с низким уровнем кортикостерона составила 143,5 ± 13,6 мм рт.ст., а у животных с высоким – 141,0 ± 18,0 мм рт.ст. Средняя величина этого показателя за три часа иммобилизации составила 143,3 ± 14,7 мм рт.ст. у крыс с низким уровнем кортикостерона и 143,5 ± 12,6 мм рт.ст. у животных с высоким уровнем гормона (рис. 1).
У группы крыс с высоким уровнем кортикостерона в плазме крови после стрессорной нагрузки в первый час иммобилизации ЧСС оказалась достоверно выше (p < 0,05), по сравнению с животными с низким уровнем кортикостерона. В первый час иммобилизации ЧСС у животных с низким уровнем кортикостерона составила237,4 ± 18,3 ударов в минуту, а у особей с высоким значением гормона – 290 ± 27,1 ударов в минуту (рис. 2). Среднее значение ЧСС в течение трех часов иммобилизации у группы крыс с высоким уровнем кортикостерона составило 238,7 ± 44,6 ударов в минуту, а у группы с низким уровнем этого гормона 225 ± 47,6 ударов в минуту. Таким образом, среднее значение ЧСС за три часа у крыс с высоким уровнем кортикостерона достоверно не отличалось от ЧСС у животных с низкой концентрацией.
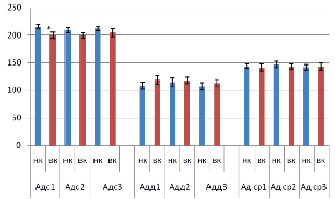
Рис. 1. Систолическое, диастолическое и среднее артериальное давление в течение первого, второго и третьего часа иммобилизации у животных с низким (НК) и высоким (ВК) уровнем кортикостерона в плазме крови. * – p < 0,005, где Адс – систолическое артериальное давление, Адд – диастолическое артериальное давление, Ад ср – среднее артериальное давление
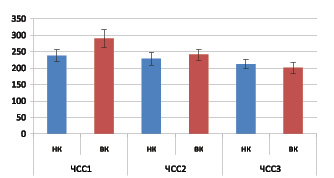
Рис. 2. ЧСС в течение первого, второго и третьего часа иммобилизации у животных с низким (НК) и высоким (ВК) уровнем кортикостерона в плазме крови. * – p < 0,05
Трехчасовая иммобилизация неодинаково влияет на индивидуальные значения уровня кортикостерона в плазме крови у различных крыс. Средняя его концентрация у животных достоверно повысилась, однако у 30 % особей после пребывания в условиях иммобилизации уровень кортикостерона, наоборот, снизился. Отсутствие корреляции уровня кортикостерона до и после стрессорной нагрузки можно объяснить выраженными и неучтенными в настоящем исследовании ритмическими колебаниями уровня этого гормона в течение суток. Как известно, в ходе так называемых ультрадианных волнообразных ритмов содержание кортикостерона в плазме крови может изменяться в несколько раз, что и вносит основной вклад в результаты при измерении уровня кортикостерона у животных в обычных нестрессорных условиях [1; 11].
Известно, что глюкокортикоиды, в частности кортикостерон, усиливают работу сердца, повышая АД. Несмотря на это, группа крыс, которая отличалась высоким уровнем кортикостерона после стрессорной нагрузки, характеризовалась достоверно более низким уровнем систолического АД. Наоборот, ЧСС и диастолическое давление, как мы и ожидали, оказались выше у группы животных с большой концентрацией кортикостерона в плазме крови. Различия АД и ЧСС между группами крыс с высоким и низким уровнем кортикостерона оказались наиболее выражены в течение первого часа стрессорной нагрузки, постепенно стираясь к третьему часу иммобилизации. Индивидуальные различия могли стираться в силу достаточной интенсивности и продолжительности трехчасового стресса.
В работе Tilahun A. с соавторами (2009) были изучены взаимосвязи между уровнем кортикостерона в крови у крыс с кровяным давлением, частотой пульса и поведением животных. Авторы не обнаружили взаимосвязь между концентрацией кортикостерона, ЧСС и АД [10]. По-видимому, из-за того, что авторы использовали менее продолжительную стрессорную нагрузку – 15-ти минутное плавание.
Заключение
Таким образом, мы обнаружили, что животные с высоким уровнем кортикостерона после стрессорной нагрузки, отличаются низким уровнем систолического АД и высоким значением ЧСС, по сравнению с животными с низкой концентрацией гормона. Наиболее выраженные различия систолического и среднего давления, а также ЧСС между группами крыс с высоким и низким уровнем кортикостерона после стресса, отмечаются в первый час иммобилизации. В последующие два часа достоверность различий исчезает.

