Первая теория растворов полимеров была дана в начале 40-х годов, независимо друг от друга Флори [9] и Хаггинсом [11] для атермических растворов. Эта теория основана на модели квази-кристаллической решетки растворов и, несмотря на то, что предназначена для неполярных растворителей, как показано, ее можно применить и к полярным, т.е. к водным растворам полимеров. Как известно, вода посредством водородных связей между молекулами имеет, некую структуры называемому кластерами, и обладает полимерными свойствами. С увеличением размеров кластеров, когда размеры кластеров приближаются к размеру молекулы полимеров, полярность воды в целом уменьшается. Таким образом, условия принятые в теории Флори Xaггинса (неполярность растворителя и совпадение размеров полимера и молекулы растворителя) удовлетворяются.
Скотт [10] впервые используя теорию Флори-Хаггинса для водных смесей двух полимеров в общем растворителе, рассчитал эффективные параметры взаимодействия полимеров. Были приняты следующие упрощенные подходы: отношение молярных объемов полимеров на молярный объем растворителя (x1, x2) и молекулярные массы полимеров одинаковы. В этом случае:
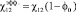 , (1)
, (1)
где ?12 – параметр взаимодействия между полимерами без
растворителя, ?0 объемная доля растворителя. Как видно из уравнения (1),
при ?0>1, эффективной параметр взаимодействия полимеров приближается
к нулю 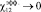 ,
и система становится однофазной. Согласно этой теории,
с увеличением молекулярных масс фазообразующих полимеров,
критические значения объемной доли растворителя-?kr.и эффективного
параметра взаимодействия полимеров –
,
и система становится однофазной. Согласно этой теории,
с увеличением молекулярных масс фазообразующих полимеров,
критические значения объемной доли растворителя-?kr.и эффективного
параметра взаимодействия полимеров – 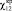 уменьшается т.е. несовместимость полимеров (фазовое расслоение)
происходит при более низких значениях параметра взаимодействия полимеров
?12. Общий растворитель системы снижает контактов молекул полимеров
друг с другом и параметр
уменьшается т.е. несовместимость полимеров (фазовое расслоение)
происходит при более низких значениях параметра взаимодействия полимеров
?12. Общий растворитель системы снижает контактов молекул полимеров
друг с другом и параметр 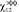 уменьшается. Этот результат полученный теорей подтверждается
в работах ряда авторов [5, 9]. В работах [3, 8] показано что,
с увеличением молекулярных масс полимеров растет несовместимость
пар полимера в общем растворителе (в воде). Этот факт можно
объяснить тем, что ряд функциональных групп (ионогеные группы,
карбоксильные группы и т.д.) содержащиеся в полимерах,
облегчают взаимодействие полимерных макромолекул с водой,
и в результате число свободных молекулы воды в системе
уменьшается, фазовое расслоение происходит при более низких
концентрациях фазообразующих компонентов. В таких случаях, происходит
экзотермическое смешивание (?Hсмеш < 0), и это приводит
к несовместимости полимеров в воде.
уменьшается. Этот результат полученный теорей подтверждается
в работах ряда авторов [5, 9]. В работах [3, 8] показано что,
с увеличением молекулярных масс полимеров растет несовместимость
пар полимера в общем растворителе (в воде). Этот факт можно
объяснить тем, что ряд функциональных групп (ионогеные группы,
карбоксильные группы и т.д.) содержащиеся в полимерах,
облегчают взаимодействие полимерных макромолекул с водой,
и в результате число свободных молекулы воды в системе
уменьшается, фазовое расслоение происходит при более низких
концентрациях фазообразующих компонентов. В таких случаях, происходит
экзотермическое смешивание (?Hсмеш < 0), и это приводит
к несовместимости полимеров в воде.
Экспериментально было определено [4], что совместимость полимеров в общем растворителе в основном происходит в смеси полимеров отличающихся по химической природе полимеров. Однако, это противоречит принципу «подобное растворяется в подобном». Для того чтобы уточнить механизм процессов совместимости и несовместимости полимеров в общем растворителе, необходимо исследовать специфические взаимодействия между молекулами полимеров, а также взаимодействия полимеров с молекулами растворителя.
Результаты исследования и их обсуждение
Добри [8] исследовал большое количество систем полимер-полимер-растворитель и показал, что если пара полимеров несовместимый в одном растворителе, то этот пара не будут совместимы и в любых других растворителях. Он, подтвердил предположения о роли растворителя в сокращении контактов между молекулами фазообразующих компонентов. В [4] было справедливо отмечено, что эксперименты, проведенные в работе [7] затормозили правильное понимание механизма разделения фаз в двухфазных системах. Позже, результаты исследования показали, что существуют много пар полимеров, которые несовместимы только в одном растворителя. Итак, еще раз следует отметить, что для того, чтобы понять механизм процесса фазового разделения системы, необходимо учитывать все виды взаимодействия между молекулами фазообразующих компонентов системы (?12; ?10; ?20). Индексы 0, 1, 2 указывают растворитель и полимеры 1 и 2 соответственно). Вышесказанное наиболее часто проявляется для систем, в которых общим растворителем является вода.
Многие авторы [1, 4, 6, 14, 15] особо отмечают ключевую роль растворителя в процессе фазового разделения раствора и ее термодинамику. Термодинамические свойства данной полимерной пары в разных растворителей впервые были исследованы в [16]. В [16] показано, что даже для небольших положительных значении параметров взаимодействия ?12 и при сильно отличающихся ?10; ?20, происходит несовместимость полимеров в системе. В [11] показано, что критические концентрации фазовое расслоение в системе полистирол-полиметилметакрилат и поливинилпирролидон-ПММА в различных растворителях непосредственно связаны с разницей в параметрах a в уравнении Марка-Куна-Хаувинка (|a1-a2|). Как известно параметр a в уравнение Марка-Куна-Хаувинка характеризует взаимодействие полимер-растворитель и связан с характеристической вязкостю [h] раствора полимеров следующим уравнением:
[??] = К?М?? , (2
)где М молекулярный вес полимера
.Как было показано, критические концентрации фазового расслоения
полимеров обратно пропорциональны разности параметров a (|a1-a2|).
Поскольку параметр a, как и параметры ?10 и ?20 характеризует
взаимодействие полимер-растворитель, то авторы [11, 17] пришли
к выводу о том, что критические концентрации фазового
расслоения полимеров в растворителе связано с разнице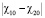 и несовместимость полимеров уменьшается с увеличением этой
разницы. Теоретически показано [16], что если взаимодействия полимеров
с растворителем отличаютс
и несовместимость полимеров уменьшается с увеличением этой
разницы. Теоретически показано [16], что если взаимодействия полимеров
с растворителем отличаютс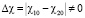 , даже совместимые полимеры без растворителей (?12 < 0) в данном растворителе становятся несовместимыми
, даже совместимые полимеры без растворителей (?12 < 0) в данном растворителе становятся несовместимыми
.Зависимость ?10 и ?20 для каждого полимера от изменении внешних факторов (например от температуры), определяет основную роль взаимодействия полимер-растворитель. Следует отметить, что значение ?? и характер растворителя также влияет на параметр ?12. При постоянной ?? даже для малых значений ?12 ??-эффект имеет большее влияние на ?12. В [17] было экспериментально подтверждена роль ??-эффекта как основного параметра характеризующего несовместимость полимера в общем растворителе.
Таким образом, анализ классической теории Флори-Хаггинс,
а также экспериментальные результаты, показывают, что совместимость
полимеров в общем растворителе, в основном определяется
параметро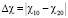 . А температурная зависимость ??-эффекта связана с температурными
зависимостями параметров ?10 и ?20 в отдельности
. А температурная зависимость ??-эффекта связана с температурными
зависимостями параметров ?10 и ?20 в отдельности
.На рис. 1 приведена температурная зависимость ?? для двухфазной системы декстран-ПЭГ-воды. Как видно из рисунка при повышении температуры, ??-эффект уменьшается и совместимость пар полимеров в воде увеличивается. Тот факт, что экспериментально найденная значения параметр взаимодействия между полимерами (?декстран-ПЭГ ? 0,05) в 10 раз меньше параметра взаимодействия полимер-растворитель (?пол.-раст. ? 0,5), еще раз подтверждает зависимость совместимости полимеров в общем растворителе от ?? = ?декстран-вода – ?ПЭГ-вода.
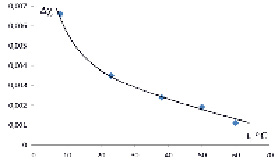
Рис. 1. Температурная зависимость ?? для двухфазной системы декстран-ПЭГ-воды
Следует отметить, что взаимодействие полимера с водой в свою очередь, тесно связано со структурой воды. С увеличением температуры роль ??-эффекта, определенная экспериментальным путем уменьшается, что связано с разрушением структура воды который приводит сближению значению параметров ?10, ?20 [2, 3].
Вычисленные значения параметров ?? для разных температур в двухфазной системе декстран-ПВП-вода представлены на рис. 2. Как видно из рисунка при повышении температуры ??-эффект уменьшается и совместимость пар полимеров в воде увеличивается.
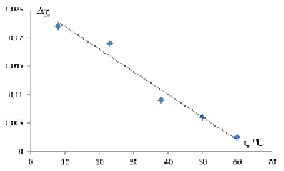
Рис. 2. Температурная зависимость ?? для двухфазной системы декстран-ПВП-воды
В предлагаемой работе исследовано также влияние различных добавок на совместимость полимеров в общем растворителе. С этой целью изучено влияние карбамида и KCl на фазовое расслоение в двухфазной системе декстран-PEQ-вода. Вычислены термодинамические параметры Хаггинса между фазообразующими компонентами в присутствии добавок. Зависимости параметра ?? от концентрации карбамида и KCl приведены на рис. 3 и 4, соответственно
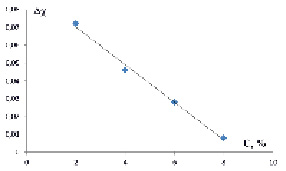
Рис. 3. Зависимость ??-эффектов от концентрации карбамида в двухфазной системы декстран-ПЭГ-воды (t = 20 °С)
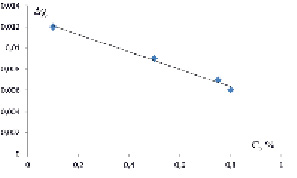
Рис. 4. Зависимость ??-эффектов от концентрации KCl в двухфазной системы декстран-ПЭГ-воды (t = 20 °С)
.Как следует из рис. 3 и 4 в обоих случаях, параметр ?? с увеличением концентрации добавок уменьшается, что свидетельствует о том, что добавки, аналогично повышению температуры, разрушают структуру воды, тем самым улучшая совместимость фазообразующих компонентов.
Таким образом, применяя теорию Флори-Хаггинса в водных растворах полимеров, можно вычислять термодинамический параметр взаимодействий полимер-полимер и полимер-растворитель и анализируя значение ??-эффекта можно определить направление фазового расслоения в двухфазных системах полимер-полимер-вода. Возможность применения теории Флори-Хаггинса для водных растворов полимеров как было отмечено выше объясняется тем, что за счет водородных связей в виде образующиеся кластеров больших размеров типа (-H2O-)n. При этом с увеличением степени полимеризации n уменьшается усредненную значения суммарного дипольного момента и уменьшается полярность растворителя и размеры кластеров и макромолекулы становится соизмеримы
.Вышеизложенные по нашему мнению делает возможным применении теории Флори-Хаггинса для водных растворов полимеров

