Современный подход в лечении дефектов нижней челюсти, нижней трети лица различного генеза состоит не только в том, чтобы устранить фунциональные и эстетические проявления посттравматических или пострезекционных изменений, но и максимально вернуть пациенту вид и функцию, которую он имел до травмы. Реконструкция обширных дефектов нижней челюсти с использованием сложных, комбинированных аутотрансплантантов по прежнему остается «золотым стандартом» в челюстно-лицевой хирургии, хотя все чаще в научной литературе встречаются статьи о применении биоинженерных конструкций. Эта тенденция обусловлена тем, что процедура имеет ряд недостатков: в 100 % случаев хирургу не удается восстановить трехмерную форму дефекта, таким образом, не всегда удается в полной мере выполнить реконструкцию дефекта и добиться как морфологической так и функциональной реабилитации пациентов. Известны значительное количество случаев, когда в неумелых руках, но при больших амбициях, хирурги не добивались положительных результатов, но и отрицательных тоже нет, пациенты отчаивались и доживали «свой век» в мучениях или просто погибали.
Именно такие случаи и подвигли нас на начало большой работы по поиску оптимального метода для реконструкции дефектов нижней челюсти. В работе мы попытаемся обобщить наш опыт в использовании сложных мягкотканых лоскутов на питающей сосудистой ножке в сочетании с материалами не биологического происхождения и дополненными мезенхимальными стволовыми клетками, биологически активными факторами роста и костной аутостружкой.
Критических размеров костные дефекты нижней челюсти достигают при тяжелых травмах, резекциях нижней челюсти различного генеза (онкологии, врожденных нарушений целостности кости), все эти факторы приводят к заметным эстетическим и функциональным нарушениям. Реконструкция полученных дефектов осуществляется при помощи аутогенных костных трансплантантов, аллогенных, ксеногенных или материалами не биологического происхождения. И, как известно, каждый из приведенных методов реконструкции имеет свои преимущества и недостатки, и конечно каждый имеет ограничения в использовании. В настоящее время широко используют, как пластический материал, при лечении критических дефектов нижней челюсти, свободные костные аутотранспланты на питающей сосудистой ножке из отдаленных участков (малоберцовой кости, подвздошной кости, лопатки и т.д.), многие считают этот метод надежной процедурой, но как показывает практика, этот метод имеет ряд существенных недостатков, таких как ограниченная доступность донорской зоны, выраженная травматизация и без того травмированного пациента, значительное время госпитализации и реабилитации пациента. И даже этот метод реконструкции дефектов не позволит выполнить полную, трехмерную реконструкцию имеющегося дефекта в полном объеме даже при использовании зубных протезов или дентальных имплантантов. Как бы мы не подходили к вопросу реконструкции дефектов нижней челюсти, конечной целью реконструкции является физиологическая и функциональная стабильность хирургической реставрации. Развитие биоинженерных технологий принесли в практическую медицину, и в реконструктивную черепно-челюстно-лицевую хирургию возможность более точно воссоздавать ткани дефекта и прогнозировать их выживаемость в зоне дефекта.
Базовая стратегия, начатой нами работы состоит из нескольких важных элементов, необходимых для образования качественной комбинированной, твердой ткани в сочетании с мягкотканым компонентом и питающими сосудами.
Наш выбор пал на лоскут широко используемый в реконструкции пострезекционных дефектов молочной железы нижне-поперечный кожно-мышечным лоскут передней брюшной стенки на основе прямой мышцы живота (Transvers Rectus Abdominis Myocutaneous flap – ТRАМ-лоскут), питающие лоскут сосуды верхняя надчревная артерии и вены.
Топографо-анатомическое обоснование использования модифицированного нижне-поперечный кожно-мышечным лоскут передней брюшной стенки на основе прямой мышцы живота (Transvers Rectus Abdominis Myocutaneous flap – ТRАМ-лоскут) как массив тканей наиболее подходящих, по нашему мнению, для созревания биоинженерной конструкции
Основным условием для успешного созревания биоинженерной конструкции, по нашему мнению, является:
– наличие достаточного массива мышечной ткани;
– наличие питающих осевых сосудов достаточного диаметра;
– возможность спокойного функционирования донорской зоны в момент созревания биоинженерной конструкции;
– возможность закрытия донорской зоны местными тканями после забора созревшей конструкции;
– возможность контроля созревания конструкции общедоступными методами;
– отсутствие дополнительной травматизации при выполнении сопутствующих вмешательств при формировании биоинженерной конструкции на первом этапе.
На наш взгляд, под эти требования подходит TRAM-лоскут, нами выполнено исследование по соответствию вышеназванных лоскутов предъявляемым требованиям.
Впервые предложен Т. Robbins (1979) как нижний поперечный эллипсовидный лоскут передней брюшной стенки. В современном виде как островковый лоскут на верхней питающей ножке прямой мышцы живота разработан и популяризирован С.R. Hartrumph с соавт. в 1982 году.
Входящие ткани: кожа, подкожно-жировая клетчатка, передняя стенка влагалища прямой мышцы живота, прямая мышца живота. Кровоснабжение через околопупочные перфоранты за счет анастомозирования с верхними надчревными сосудами (из внутренних грудных артерии и вены). Размеры в среднем 14 см в высоту и 25 см в ширину.
Разметка лоскута, особенности выделения, техника операции
Снизу линию разреза намечаем на 2 см выше лона. Сверху разрез проводим выше пупка для включения в состав лоскута околопупочных перфорантов. Сбоку выделение проводим от передней подмышечной линии. Лоскут поднимаем над апоневрозом наружной косой мышцы живота и передней стенкой влагалища прямой мышцы до первого ряда перфорантов, который находится на 1–2 см медиальнее наружного края мышцы. С другой стороны кожно-жировой слой поднимаем до белой линии живота. Второй, медиальный ряд перфорантов 3,5–4 см кнутри от первого ряда, в 5–10 мм кнаружи от внутреннего края прямой мышцы живота. При взятии мышечной ножки во всю ширину обеспечивается более надежное кровоснабжение лоскута, но требуется закрытие донорского дефекта сетчатым имплантатом в дальнейшем. Здесь важно оставить 1–2 см переднего листка влагалища прямой мышцы живота интактным для подшивания сетки. Нижние надчревные сосуды выделяем и пересекаем в 3 см ниже полулунной линии. Донорскую рану возможно укреплять выполнив пластику апоневроза полипропиленовой сеткой. Дренировать стандартно, a ушивать при подсаживании пациента на 45°. Рубец донорской зоны хорошо будет скрыт нижним бельем.
Топографо-анатомическая часть начатого исследования выполнена нами на 17 нефиксированных трупах, 9 мужчин и 8 женщин, умерших в возрасте от 40 до 65 лет по причине различных травм и заболеваний не связанных с повреждением исследуемой нами области. От каждого трупа получено по одному препарату: мужчины; 9-TRAM-flap; женщины; 8-TRAM-flap.
Всего было исследовано 10 препаратов при помощи ренгенконтрасных инъекций. Особенно обращаем внимание на то, что исследованные препараты не имели видимых повреждений, a время после наступления биологической смерти не превышало 12 часов. Во всех случаях определяется выраженная сосудистая сеть лоскутов, хороший мышечный массив позволяющий адекватно сохранить биоматериал в период его созревания, более того кожная подушка, при необходимости, позволит выполнить реконструкцию и значительных дефектов мягких тканей.
TRAM-лоскут
Топография передней стенки живота
Кожа данной области подвижна, эластична, что ранее очень широко использовалось в пластических целях при пластике дефектов лица (метод филатовского стебля).
Подкожная жировая клетчатка делится поверхностной фасцией на два слоя, степень развития ее может быть различной у разных людей. В области пупка клетчатка практически отсутствует, вдоль белой линии развита слабо.
Поверхностная фасция состоит из двух листков – поверхностного и глубокого (фасция Томпсона). Глубокий листок гораздо прочнее и плотнее поверхностного и прикрепляется к паховой связке.
Собственная фасция покрывает мышцы живота и срастается с паховой связкой.
Наиболее поверхностно располагается наружная-косая мышца живота. Она состоит из двух частей: мышечной, расположенной более латерально, и апоневротической, лежащей кпереди от прямой мышцы живота и участвующей в формировании влагалища прямой мышцы. Нижний край апоневроза утолщается, подворачивается вниз и внутрь и формирует паховую связку.
Более глубоко располагается внутренняя косая мышца живота. Она также состоит из мышечной и апоневротической части, однако апоневротическая часть имеет более сложное строение. Апоневроз имеет продольную щель, расположенную на уровне около 2 см ниже пупка (линия Дугласа, или дугообразная). Выше этой линии апоневроз состоит из двух листков, один из которых располагается спереди от прямой мышцы живота, a другой – сзади от нее. Ниже линии Дугласа оба листка сливаются друг с другом и располагаются спереди от прямой мышцы.
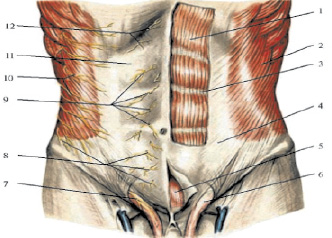
Рис. 1. Слои переднебоковой брюшной стенки (из: В.Н. Войленко и др., 1965): 1 – прямая мышца живота; 2 – наружная косая мышца живота; 3 – перемычка между сегментами прямой мышцы; 4 – апоневроз наружной косой мышцы живота; 5 – пирамидальная мышца; 6 – семенной канатик; 7 – подвздошно-паховый нерв; 8 – передние и латеральные кожные ветви подвздошно- подчревного нерва; 9, 12 – передние кожные ветви межреберных нервов; 10 – латеральные кожные ветви межреберных нервов; 11 – передняя стенка влагалища прямой мышцы живота
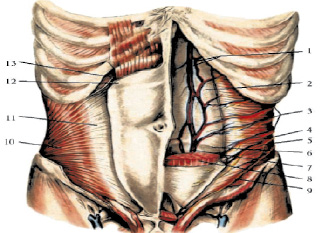
Рис. 2. Глубокие кровеносные сосуды переднебоковой брюшной стенки (из: В.Н. Войленко и др., 1965): I – верхние надчревные артерия и вена; 2, 13 – задняя стенка влагалища прямой мышцы живота; 3 – межреберные артерии, вены и нервы; 4 – поперечная мышца живота; 5 – подвздошно-подчревный нерв; 6 – дагообразная линия; 7 – нижние надчревные артерия и вена; 8 – прямая мышца живота; 9 – подвздошно-паховый нерв; 10 – внутренняя косая мышца живота; II – апоневроз внутренней косой мышцы живота; 12 – передняя стенка влагалища прямой мышцы живота
Прямая мышца живота располагается в средней части живота. Волокна ее направлены сверху вниз. Мышца разделена 3–6 сухожильными перемычками и лежит в собственном влагалище, сформированном за счет апоневрозов внутренней и наружной косых и поперечной мышц живота. Передняя стенка влагалища представлена апоневрозом наружной косой и частично внутренней косой мышц живота. Она рыхло отделена от прямой мышцы, но срастается с ней в области сухожильных перемычек. Задняя стенка сформирована за счет апоневроза внутренней косой (частично), поперечной мышц живота и внутрибрюшной фасции и нигде с мышцей не срастается, формируя клетчаточное пространство, в котором проходят верхние и нижние надчревные сосуды. При этом соответствующие вены в области пупка соединяются друг с другом и формируют глубокую венозную сеть. В ряде случаев прямая мышца живота снизу подкрепляется пирамидальной мышцей.
Поперечная мышца живота лежит глубже всех остальных. Она также состоит из мышечной и апоневротической частей. Ее волокна располагаются поперечно, при этом апоневротическая часть гораздо шире мышечной, в результате чего в месте их перехода имеются небольшие щелевидные пространства. Переход мышечной части в сухожильную имеет вид полукруглой линии, называемой полулунной, или линией Спигеля.
Соответственно линии Дугласа апоневроз поперечной мышцы живота также расщепляется: выше этой линии он проходит под прямой мышцей живота и участвует в формировании задней стенки влагалища прямой мышцы, a ниже линии участвует в формировании передней стенки влагалища.
Под поперечной мышцей располагается внутрибрюшная фасция. Необходимо отметить, что апоневрозы левых и правых косых и поперечных мышц живота по средней линии срастаются друг с другом, формируя белую линию живота. Учитывая относительную бедность сосудами, наличие связи между всеми слоями и достаточную прочность, именно белая линия живота является местом наиболее быстрого хирургического доступа при вмешательствах на внутренних органах живота.
Этапы выделения лоскута
Имеется значительный объем кожи, которую можно успешно использовать при реконструкции комплексных дефектов средней и нижней зон лица. Объем, форму кожной подушки можно выполнить любую, в соответствии с формой дефекта.
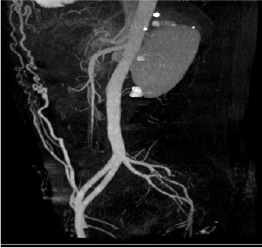
Рис. 3. КТ-ангиография сосудов TRAM-flap. (Предоперационное планирование)
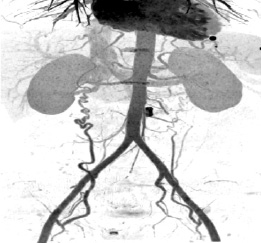
Рис. 4. Кт-Ангиография TRAM-flap (хорошо определяются питающие лоскут кровеносные сосуды)

Рис. 5. Дизайн лоскута, при условии забора вместе с кожной подушкой
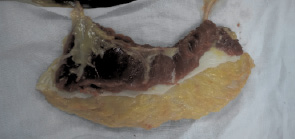
Рис. 6. Внешний вид, готового к трансплантации лоскута, питающие сосуды не пересечены

Рис. 7. Диаметр питающих лоскут сосудов
На рис. 6 хорошо виден мышечный массив, способный «укрыть» биоинженерную конструкцию на этапе ее созревания, определяется хорошо развитая сосудистая сеть, выраженные осевые кровеносные сосуды позволяющие качественно и без особых трудностей выполнить сосудистый шов при аутотрансплантации лоскута.
Результаты
Всего, в процессе исследования, было получено и пристально изучено 17 TRAM-лоскутов. Все полученные лоскуты не повреждены, a смерть пациентов не связана с патологией изучаемой области. При выполнении работы мы пришли к выводу, что использование данного лоскута допустимо в создании биоинженерной конструкции в комплексе с нетканым титановым материалом со сквозной пористостью для реконструкции дефектов нижней челюсти. Место расположения, мышечный массив данной области, диаметр магистральных сосудов способны обеспечить качественное «созревание», аутотрансплантацию и перспективную реконструкцию дефектов нижней челюсти. Использование TRAM-лоскута позволит добиться необходимого уровня эстетической и функциональной реабилитации пациентов с дефектами нижней челюсти, a использование его в создании биоинженерной композиции в сочетании с нетканым титановым материалом со сквозной пористостью позволяет быстро, малоинвазивно производить забор костного материала необходимого для создания биоинженерной конструкции, подсадки для «созревания» конструкции и последующей аутотрансплантации в зону реконструкции, что может способствовать улучшению результатов хирургической реабилитации пациентов с дефектами нижней челюсти.

