На протяжении последних сорока пяти лет доказана удивительная способность кости к регенерации при удлинении конечности (в клинике и эксперименте величина удлинения сегмента конечности достигает 50–70 % от исходной длины), что является показателем больших потенциальных возможностей восстановительных процессов организма. Фактором, индуцирующим остеогенез при удлинении, служит напряжение растяжения, создаваемое и постоянно поддерживаемое в процессе удлинения [6]. Важно, что оно является общим этиологическим (запускающим) фактором, стимулирующим регенераторные процессы не только в кости, но и в мышцах, сосудах, нервах конечности, подвергающейся удлинению. Наличие общего этиологического фактора (динамического растяжения) и единых патогенетических механизмов (системных реакций крови и кроветворения в виде активации пролиферативной, энергетической, секреторной реакций, изменений рецепторного аппарата иммунокомпетентных клеток; увеличения количества и функции фибробластов; возрастания интенсивности кислородзависимых процессов) дает достаточно оснований считать восстановление тканей при удлинении конечности (дистракционный гистогенез) самостоятельной разновидностью физиологической регенерации [13]. Разноплановые и многочисленные исследования мышечной системы нижней конечности при удлинении позволили выявить характерные изменения, как на органном уровне, так и в различных структурных элементах мышечной ткани в зависимости от условий удлинения [4, 7, 14].
Современные требования страховой медицины стимулируют развитие новых технологий, направленных на сокращение сроков пребывания травматолого-ортопедических больных в стационаре, но пока это никак не отражается на времени функциональной реабилитации пациента после дозированного удлинения конечностей методом Илизарова, которое во многом определяется сохранностью скелетных мышц, их физиологическими и гистологическими характеристиками. Появления новых технологий остеосинтеза, связанных с направленным воздействием на гистогенез различных тканей и основные функции костного мозга [12, 22] позволяют надеяться на выявление тонких механизмов, участвующих в регенераторных процессах не только костей, но и мышечного аппарата. Использование их в практической работе врачей помогает повысить эффективность лечения многих заболеваний.
Цель работы – морфофункциональный анализ передней большеберцовой мышцы при дистракции голени в сочетании с интрамедуллярным напряженным армированием и одномоментной компрессией дистракционного регенерата.
Материалы и методы исследования
Работа выполнена на 27 беспородных собаках в возрасте скелетной зрелости, контроль составила группа из трех интактных животных. Экспериментальным животным после закрытой флексионной остеоклазии берцовых костей правой голени на уровне диафиза осуществляли дистракционный остеосинтез аппаратом Илизарова. Удлинение производили со скоростью 1,0 мм в день (по 0,25 мм за 4 приема) – I серия (n = 9), во II серии дополнительно осуществляли интрамедуллярнoе армирование интрамедуллярными спицами (n = 9), в III – после удлинения голени (идентично 1 серии) и фиксации в течение 30 дней производили одномоментную компрессию дистракционного регенерата (n = 9). Во всех сериях период дистракции составил 28 дней, фиксации – 30 суток и без аппарата – 30 суток. Манипуляции, содержание и выведение животных из эксперимента осуществляли согласно приказу № 755 от 12.08.77 г. МЗ СССР «О гуманном обращении с экспериментальными животными».
Для морфологического исследования фрагмент передней большеберцовой мышцы иссекали в области, прилежащей к большеберцовой кости, после альдегидно-осмиевой фиксации и дегидратации заливали в эпон-аралдит. Изготавливали полутонкие срезы с помощью ультратома Nova (LKB, Швеция), окрашивали метиленовым синим и основным фуксином по Уикли или по M.Ontell, исследовали в световом микроскопе Opton (Германия), изображения оцифровывали посредством встроенной фотокамеры и АПК ДиаМорф (Россия), программа Color. Поперечные криостатные срезы с выявленной активностью миозиновой АТФ-азы (рН 9,0) по Padycula, German использовали для стереометрии. Сбор первичных данных осуществляли на проекционном микроскопе Visopan (Reichert-Jung, Австрия), на экран которого помещали закрытую тестовую решетку коротких отрезков с известной площадь. Определяли объемную плотность мышечных волокон, микрососудов и эндомизия (VVМВ, VVМС, VVЭ, мм3/мм3); поверхностную и численную плотность мышечных волокон (SVМВ, мм2/мм3, NAМВ, мм–2) и микрососудов (SVМС, мм2/мм3, NAМС, мм–2) [9]. Рассчитывали: индекс васкуляризации (NAМС/NAМВ), косвенно оценивающий степень оксигенации ткани, площадь гематканевой диффузии (SVМС/SVМВ). Данные обрабатывали методами непараметрической статистики в программе AtteStat версия 10.8.8, встроенной в Microsoft Excel [2], достоверность различий определяли на основании критерия Вилкоксона, статистически значимыми считали различия при р ≤ 0,05, где р – уровень значимости этого критерия.
Результаты исследования и их обсуждение
В передней большеберцовой мышце всех экспериментальных серий были выявлены характерные структурные реакции: попарно и группами расположенные миобласты (рис. 1, А), миосимпласты, активированные клетки с крупными светлыми ядрами и хорошо развитой цитоплазмой вблизи микрососудов, что характерно для миосателлитоцитов второго типа, обратимые и необратимые контрактуры мышечных волокон (рис. 1, В). В эндо- и перимизии наблюдались множественные фибробласты, расположенные в направлении вектора напряжения растяжения (рис. 1, С), лаброциты, скопления адипоцитов. В III серии дополнительно были отмечены волокна с измененным контуром и нарушенной поперечной исчерченностью (рис. 1, D), наблюдались волокна с «отделяющимися» концевыми фрагментами, содержащими реактивно измененные светлые ядра (рис. 1, E, F).
По данным стереологического анализа значение параметра, оценивающего уровень васкуляризации мышцы, через месяц фиксации во II и III сериях был несколько ниже, чем в I, составив, соответственно, 83 и 93 % (табл. 1). Площадь гематканевой диффузии составила 45 и 58 % во II и III сериях, соответственно, от значения в I серии. В конце эксперимента индекс васкуляризации во II и III сериях составлял 122 и 193 %, площадь гематканевой диффузии – 125 и 188 % от значений в I серии, соответственно.
Объемная плотность мышечных волокон во II и III сериях на протяжении эксперимента сохранялась на одном уровне, близком к значению в интактной группе и была достоверно выше в обеих сериях относительно I (Р < 0,05), составив через месяц фиксации и после снятия аппарата, соответственно, 112 и 129 %.
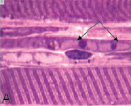
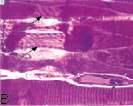
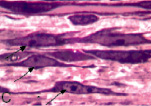

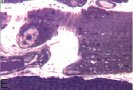

Рис. 1. Гистоструктура передней большеберцовой мышцы: I и II серий (вверху), III серии эксперимента (внизу): А – миобласты; В – контрактурно измененные мышечные волокна (стрелки); С – фибробласты, расположенные в направлении вектора напряжения растяжения; D – измененный контур мышечного волокна; E, F – концевые фрагменты мышечных волокон с реактивно измененными ядрами. Продольные полутонкие срезы, окраска по M. Ontell, увеличение: 1250х, С – 500х
Поверхностная плотность микрососудов через месяц фиксации во II и III сериях составляла 46 и 67 %, соответственно, от значений в I серии (Р < 0,05). Однако, если в I серии через месяц после демонтажа аппарата Илизарова SVМС снижалась относительно предыдущего срока в 1,7 раза (Р < 0,05), то во II и в III сериях – возрастала в 1,6 и 1,4 раза, соответственно, составив 128 и 157 % от значения в I серии.
Доля объема, занимаемая эндомизием, во II и III сериях не различались значимо между собой. Однако через 30 суток фиксации данный параметр во II и III сериях составил 45 и 38 % от значений в I серии (Р < 0,05). Через месяц после снятия аппарата этот параметр так же снижался, составив 23 и 15 % от значения в I серии.
Данные литературы свидетельствуют о принципиальном сходстве структурной реорганизации скелетных мышц, подвергающихся разнообразным экспериментальным воздействиям [1]. Комплексная патоморфологическая картина складывается из уникальных количественных и качественных комбинаций стандартных элементов, в основе которых лежат типовые очаговые повреждения соматической мускулатуры: контрактуры I–IV степени и внутриклеточный миоцитолизис, a также активация миосателлитоцитов при регенерации [3, 25].
Эффект стимулирующего влияния напряжения растяжения на рост и регенерацию, открытый профессором Г.А. Илизаровым, проявляется в отношении не только костной ткани. Для регенерации и роста любая ткань должна перейти в особое состояние, сопровождающееся повышением пластической активности и нарушением нормального функционального режима. Это состояние характеризуется при травме костей голени не только снижением сократительной способности мышц, увеличением их упругости, но и ускорением шунтового кровотока, трансмиссией давления в микрососудистое русло, повышением фильтрации плазмы крови в ткани, снижением скорости компенсации ишемических сдвигов при проведении пробы с окклюзией артерий бедра [17]. Такие изменения сопровождают переход тканей от состояния упругой деформации к пластической. После прекращения дистракции, по мере нормализации регионарного и увеличении капиллярного кровотока ускоряется минерализация костного регенерата, начинается восстановление и сократительной способности мышц. Этот процесс при классическом (по Илизарову) удлинении конечности протекает очень медленно.
Стереологические параметры передней большеберцовой мышцы при дистракции голени в режиме 1,0 мм за 4 приема и в различных вариантах стимуляции остеогистогенеза
|
Срок эксперимента Параметры |
Интактная группа |
Д28Ф30 I серия 1 за 4 |
Д28Ф30 II серия Спицы |
Д28Ф30 III серия ДКОС |
БА30 I серия 1 за 4 |
БА30 II серия Спицы |
БА30 III серия ДКОС |
|
VVмв, мм3/мм3 |
0,9083±0,0017 |
0,8164 ± 0,0038*Δ |
0,9113 ± 0,0110 |
0,9252 ± 0,0039*□ |
0,7239 ± 0,0080*Δ |
0,9251 ± 0,0033* |
0,9356 ± 0,0076*□ |
|
SVмв, мм2/мм3 |
888,3±10,6 |
1080,0 ± 16,1* |
1029,1 ± 38,9*▼ |
1257,7 ± 26,5*□ |
1061,5 ± 15,5*□ |
1091,6 ± 21,2*▼ |
891,2 ± 40,0 |
|
NAмв, мм-2 |
504,1±6,4 |
926,7 ± 19,9*Δ |
766,1 ± 19,2* ▼ |
947,0 ± 23,9* |
843,6 ± 22,8*Δ |
1041,1 ± 30,3*▼ |
629,2 ± 27,2*□ |
|
VVмc, мм3/мм3 |
0,0256±0,0013 |
0,0436 ± 0,0024*Δ |
0,0192 ± 0,0030 |
0,0208 ± 0,0020□ |
0,0411 ± 0,0022*Δ |
0,0274 ± 0,0023■ |
0,0256 ± 0,0042□ |
|
SVмc, мм2/м3 |
103,2±4,1 |
170,2 ± 8,0*Δ |
77,9 ± 13,3▼ |
113,8 ± 10,9□ |
98,9 ± 6,8Δ |
126,8 ± 9,5* |
155,6 ± 16,6*□ |
|
NAмc, мм-2 |
703,0±82,1 |
1009,0 ± 29,3*Δ |
695,4 ± 32,9▼ |
961,2 ± 26,3* |
737,9 ± 11,3*Δ |
1105,3 ± 30, 5* |
1058,4 ± 50,0*□ |
|
VVcт, мм3/мм3 |
0,0662±0,0017 |
0,1400 ± 0,0044*Δ |
0,0588 ± 0,0047* |
0,0534 ± 0,0030*□ |
0,2340 ± 0,0049*Δ |
0,0475 ± 0,0027* |
0,0356 ± 0,0054*□ |
|
NAмc/NAмв |
1,395 |
1,089 |
0,908 |
1,015 |
0,875 |
1,062 |
1,682 |
|
SVмc/SVмв |
0,116 |
0,158 |
0,076 |
0,091 |
0,093 |
0,116 |
0,175 |
|
Rдиф., мкм |
23,3±0,9 |
19,5 ± 0,6 |
23,5 ± 0,7 |
20,0 ± 0,6 |
22,8 ± 1,3 |
18,7 ± 0,5 |
19,1 ± 0,6 |
Примечание. Различия достоверны при Р ≤ 0,05:
* – различия достоверны между интактной группой и экспериментальными сериями;
Δ – I серия – II серия, □ – I серия – III серия, ▼ – II серия – III серия.
Мы рассматриваем механизм удлинения мышцы при дистракционном остеосинтезе следующим образом [10]. Соединительнотканные оболочки мышцы (эндомизий, перимизий и эпимизий) анатомически тесно связаны с сухожилием, которое является их естественным продолжением. Благодаря решетчатому расположению пучков коллагеновых волокон, при удлинении конечности происходит растяжение этого соединительно-тканного каркаса. Углы пересечения волокон максимально уменьшаются, уменьшается периметр мышечного брюшка и условно можно выделить три фазы в процессе анатомо-функциональной адаптации мышцы к условиям дистракционного остеосинтеза:
– фаза преимущественного растяжения, когда удлинение происходит за счет изменения решетки ССМ и деспирализации коллагенового волокна (продолжается 2–4 недели);
– фаза отсроченной регенерации коллагенового волокна, когда на фоне полного растяжения значительно увеличивается масса коллагеновых волокон, уплотняются их пучки, возрастает площадь, занимаемая ССМ, и уменьшается масса паренхимы мышцы (продолжается до момента прекращения удлинения конечности);
– фаза реабилитации – восстановление спиралевидности коллагеновых волокон и архитектуры решетки коллагеновых пучков (продолжается с момента прекращения дистракции и до момента полного функционального восстановления мышцы).
Исходя из данного представления об особенностях морфологической адаптации мышцы в условиях дистракционного остеосинтеза, можно объективно объяснить причины длительной, не менее года, функциональной реабилитации больных после удлинения конечностей. Клинико-нейрофизиологические данные, полученные при устранении асимметрии в длине верхних и нижних конечностей врожденной и приобретенной этиологии, свидетельствуют о появлении в процессе дистракции признаков глубокой структурной перестройки в периферической части двигательных единиц, нарушений нейротрофического контроля мышечных волокон, снижения контрактильных характеристик мышц и их суммарной биоэлектрической активности (активность мышц падает практически до нуля с первых дней удлинения) [16].
Период релаксации – это начало восстановления структурной решетки оболочек мышечного брюшка. Вначале восстанавливается спиралевидный характер коллагенового волокна. Это очень важный момент функциональной реабилитации мышцы. В результате снижается внешнее давление на мышечное волокно, улучшаются условия капиллярного кровотока и функционирования нервно-мышечного синапса, появляется запас пространства для увеличения периметра мышечного брюшка как за счет сокращения в актино-миозиновом комплексе, так и за счет регенерации новых мышечных волокон. Улучшение капиллярного кровотока и оксигенации тканей способствует регенерации паренхимы мышцы и снижает уровень пролифирации соединительной ткани.
Ускорить период релаксации можно, одномоментно сблизив костные фрагменты удлиняемого сегмента, на «высоту зоны роста костного регенерата» (этот прием предложен В.И. Шевцовым и А.В. Попковым в 1994 году с целью стимуляции регенераторного процесса кости). Сближение точек прикрепления мышцы во время этой манипуляции ведет к быстрому восстановлению спиралевидности коллагенового волокна в составе ССМ (рис. 2.). Появляется запас пространства для утолщения мышечного волокна во время активного сокращения миофибрилл. В этот период создаются благоприятные биомеханические условия для активной функциональной реабилитации мышцы. Лечебно-восстановительный комплекс мероприятий должен включать, прежде всего, упражнения, связанные с активным сокращением мышцы, с увеличением амплитуды движений в суставах.
Рис. 2. Восстановление спиралевидности коллагеновых волокон перимизиума и эндомизиума в первый день после одномоментной компрессии дистракционного регенерата (гистотопограмма, увеличение x300)
Известно, что при дистрактной нагрузке изменяются как структура мышечной ткани, так и основные метаболические процессы (тенденция к активизации гликолитического рефосфорилирования АТФ). Через 4–6 недель дистракции возрастает активность окислительно-восстановительных ферментов при сохранении высокой активности АТФ-азы, через 8 недель – снижается активность СДГ и АТФ-азы при умеренном повышении активности a-глицерофосфатдегидрогеназы [5, 14, 15]. При метаболических сдвигах развитие контрактур мышечных волокон начинается от признаков альтерации к более сложной картине с увеличением доли репаративных и остаточных изменений. Повреждения складываются из смены фаз развития пересокращения (I–III степень) фазой некробиоза (IV степень) с последующим глыбчатым распадом и макрофагальной резорбцией. Контрактуры I–II степени считают обратимыми, III и IV степени относят к разряду необратимых изменений, когда при контакте с циркулирующей кровью происходит пропитывание клеток плазмой, что обусловливает темное окрашивание [1, 8]. При дистракционно-компрессионном остеосинтезе значения амплитуды М-ответа мышц свидетельствуют о снижении их функциональной активности, наиболее выраженной на 35 день дистракции и 14 день фиксации, что объясняется интенсификацией физиологической и активизацией репаративной регенерации мышечных волокон, сопровождаемой угнетением их функции [11]. Имеют место направленный морфогенез тканевых структур, два механизма регенерации: внутриклеточный (миосимпластический) и клеточный (активизация миосателлитоцитов, увеличение их числа).
Наблюдаемое большое количество клеток с крупными эухроматичными ядрами, расположенных одиночно или группами, a так же вблизи микрососудов, считаем возможным отнести к клеткам-сателлитам второго типа. Известно, что для увеличения количества миосателлитоцитов достаточно легкой компрессии, не вызывающей дегенеративных изменений, эти клетки активизируются, например, после тренировки, растяжения, воздействия холодом, или при денервации [18]. Миосателлитоциты-II, локализованные вблизи микрососудов, выполняют трофическое обеспечение мышечных волокон, что основывается на обнаружении большого количества микропиноцитозных пузырьков, соединенных с цитолеммой клеток-сателлитов, a так же непосредственно участвуют в ангио- и миогенезе [20]. На связь сателлитоцитов с трофическим обеспечением мышечного волокна указывает и то, что 87 % их концентрируются вблизи нервно-мышечных синапсов [25]. Подобные клетки с характерными ядрами и развитой цитоплазмой вблизи микрососудов были характерны для мышц всех исследованных серий.
Площадь гематканевой диффузии и индекс васкуляризации по окончанию эксперимента, оказавшиеся почти вдвое выше в условиях стимуляции остеогенеза, могут свидетельствовать о том, что интрамедулярное напряженное армирование и в большей степени одномоментная компрессия дистракционного регенерата, оказывают положительное влияние на кровоснабжение передней большеберцовой мышцы. Значительно меньшая объемная плотность микрососудов при большей их численной и поверхностной плотности, может свидетельствовать о неоваскулогистогенезе либо открытии резервных микрососудов.
Значительно меньшая доля объема соединительнотканного компонента и большая мышечных волокон, выполняющих главную функцию мышцы – сократительную, в сериях со стимуляцией остеогенеза, свидетельствует о существенном снижении уровня склеротизации мышечной ткани и улучшении ее специфической функции – сокращения. Полученные результаты согласуются с данными литературы о стимуляции остеогенеза аналогичными методами [12]. Так же давно известно, что мышцы хорошо адаптируются к дистракционным нагрузкам, при этом легко увеличивается количество саркомеров с тем, чтобы сохранить/восстановить оптимальную их длину [24]. Наличие саркомерогенеза было подтверждено и в новых работах с помощью математической модели на основе экспериментальных данных [26]. Приведенные факты могут служить объяснением к достоверно увеличивающейся объемной плотности мышечных волокон по окончанию эксперимента при стимуляции остеогенеза. Новообразование мышечных волокон в нашем исследовании подтверждается и данными электронно-микроскопического анализа: «…по бокам и на концах мышечных волокон в подсарколеммальных участках саркоплазмы наблюдается активный миофибриллогенез» [11]. Известно, что наибольшее увеличение числа саркомеров наблюдается в мышцах, состоящих, в основном, из волокон I типа (медленно сокращающихся окислительных), содержащих большое количество митохондрий, как правило, в 2–3 раза выше, чем в волокнах II типа (быстро сокращающихся гликолитических) [21]. Недавно было признано, что митохондрии обуславливают не только фенотип мышцы, но и дифференцировку миобластов и, соответственно, рост мышц [19].
Таким образом, при дистракции, в том числе в условиях стимуляции остеогенеза, в передней большеберцовой мышце преобладают типичные структурные реакции адаптационного характера по типу реституции: обратимые контрактуры мышечных волокон I–II степени, активированные миосателлитоциты, миобласты, фибробласты, расположенные в направлении вектора напряжения растяжения, лаброциты, небольшие группы адипоцитов. В результате проведенного стереометрического анализа выявлена лучшая васкуляризация мышечной ткани при стимуляции, в большей степени в условиях компрессии регенерата, и существенно меньший уровень склеротизации с увеличением объемной доли сократительного аппарата, несущего основную функциональную нагрузку.

