За последние годы одной из сфер применения неводных растворов стало их использование в качестве электролитных систем различных химических источников тока (ХИТ) с литиевым анодом.
Некоторые ХИТ такого типа достигли стадии промышленного производства. В частности, литиевые ХИТ на основе электродных пар Li/SOCl2 и Li/SО2.
Источники тока системы литий – тионилхлорид (Li/SOCl2) обладают самыми максимальными из всех разработанных в настоящее время литиевых источников тока значениями удельной энергии. Весовая удельная энергия элементов составляет 500-700 Вт·ч/кг, а его удельная объемная энергия достигает 1000 Вт·ч/л [1-3]. Более того, эти элементы обладают длительным сроком хранения (потеря емкости составляет ~ l–2 % в год при комнатной температуре), а также могут эксплуатироваться в исключительно широком диапазоне температур (от минус 70 °C до 80 °C). По удельной мощности они ниже элементов Li/SO2 и находятся на уровне 30 – 50 Вт/кг и 50 – 70 Вт/дм3. Выполненные в резервном варианте, эти элементы могут развивать мощности до 1 кВт/кг. Это связано с особенностями формирования пленки на литиевом электроде [4].
Элементы Li/SOCl2 имеют высокое разрядное напряжение (от 3 до 3,5 В), стабильную разрядную характеристику и отсутствие выделения газов при герметичном исполнении элементов.
Одним из наиболее перспективных направлений улучшения эксплуатационных характеристик элементов типа Li/SOCl2, в которых электролитными системами являются растворы солей А1(Ш) в SOCl2, основывается на усложнении состава электролитных систем путем введения органических или неорганических апротонных растворителей. Однако A1C13 растворяет пассивирующую пленку хлорида лития на литии и таким образом увеличивает его коррозию.
В качестве электролита используют раствор LiAlCl4 в SOCl2 концентрацией 1,5-2,0 моль/л. В работе [5] предложены модифицированные электролиты с добавками галогенов. К недостаткам следует отнести высокую коррозионную активность тионилхлорида и его токсичность.
Элементы систем Li/SOCl2 существенно превосходят по емкости и удельной энергии при низких температурах элементы других электрохимических систем. Характерной особенностью их является провал напряжения в начальный момент разряда после длительного хранения, выраженного более сильно, чем у элементов системы Li/SO2. После длительного хранения, особенно при повышенных температурах, напряжение в момент включения элемента падает практически до нуля и затем в течение определенного времени (может составлять несколько минут) медленно достигает своего рабочего значения. Для исключения этого явления проводили исследования по влиянию различных добавок в SOCl2 на сохранность элементов [5]. Наибольший эффект дали добавки декахлорбората (Li2B10Cl10) в электролит, которые препятствуют росту пассивирующей пленки и практически исключают провал напряжения.
Кроме элементов с залитым жидким окислителем, рассматриваются создание Li/SOCl2 батарей резервного типа с длительной сохранностью. Среди других систем с апротонным электролитом системе литий-тионилхлорид уделяется наибольшее внимание как перспективной для применения в интенсивных режимах разряда мощных источниках тока.
Одной из причин, сдерживающих применение литий – тионилхлоридных ХИТ, является малая сохранность мощности из-за быстрой пассивации литиевого электрода. Экспериментальным путем были выбраны составы электролитов, определяемые назначением ХИТ представляющие собой растворы ионогенных веществ: хлорида лития гидроокиси лития, хлорида алюминия и сернистого газа в хлористом тиониле. Выбранные составы позволили увеличить сохранность элементов до трех лет с потерей емкости 10 – 25 %.
Однако еще не созданы источники тока с энергетическими параметрами, близкими к теоретическим, в существующих ХИТ не устранен провал напряжения и ряд других недостатков. Значительного прогресса в решении указанных проблем следует ожидать в подборе электролитных систем, которые играют ключевую роль в процессе разработки источников тока указанного типа [6–8].
Материалы и методы исследования
Коррозионные потери лития определяли гравиметрическим методом, кислотно-основным титрованием. Образцы для коррозионных испытаний готовили из литиевой фольги размером 20х22 мм, толщиной 300–400 мкм.
Все работы по изготовлению электродов и приготовлению растворов электролитов проводили в боксе с воздухом, осушаемом фосфорным ангидридом. Технологически использование сухого воздуха наиболее удобно и экономически выгодно.
Литиевые образцы хранили в запаянных стеклянных ампулах при температурах 20, 40, 60 °С. Температуру поддерживали с точностью ± 0,3 °С в специально оборудованных термошкафах.
Скорость коррозии лития рассчитывали по изменению массы образцов:
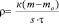 ,
,
где r – скорость коррозии, г/(м2.ч);
mо – масса образца до хранения, г;
m – масса образца после хранения, г;
s – площадь образца, м2;
t – время хранения, ч;
к – коэффициент, учитывающий нерастворимые продукты реакции.
После хранения в электролите литиевый образец отмывали в тионилхлориде и в осушенном диэтиловом эфире. Затем образец растворяли в определенном объеме бидистиллированной воды. Полученный раствор гидроксида лития титровали раствором соляной кислоты в присутствии метилового оранжевого. Хлорид лития, образующийся на поверхности литиевого образца в результате коррозии, не мешает титрованию. Массу лития после коррозии определяли по формуле:
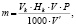
где Vk – объем кислоты, пошедший на титрование, мл;
Нk – эквивалентная концентрация кислоты, равная 0,1 н;
V – анализируемый объем раствора, мл;
V' – объем анализируемого титруемого раствора, мл.
Скорость коррозии рассчитывали по формуле:
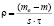 ,
,
где mо – масса образца до хранения, г;
m – масса лития после хранения, г.
Результаты исследования и их обсуждение
В литературе отсутствуют сведения о коррозионных потерях лития в тионилхлоридных растворах с добавкой гидроксида лития. Установлено, что при длительном хранении в растворах Li[Al2Cl6OH] литий корродирует. В табл. 1 показано влияние температуры и времени хранения литиевых образцов в тионилхлоридном растворе Li[Al2Cl6OH] с концентрацией AlCl3 1 моль/л с различным содержанием LiOH на коррозию лития. Коррозионные потери лития рассчитывали по усредненным данным, полученным гравиметрическим методом и методом кислотно-основного титрования.
Таблица 1
Коррозия лития в растворах электролита Li[Al2Cl6OH] с различным содержанием LiOH и времени хранения в зависимости от температуры
|
Температура раствора, °С |
Концентрация LiOH, моль/л |
Коррозионные потери лития, г/м2 |
|||||
|
Время хранения, сутки |
|||||||
|
13 |
30 |
60 |
90 |
120 |
150 |
||
|
20 |
0,125 |
2,73 |
4,20 |
6,02 |
7,84 |
9,33 |
10,44 |
|
0,25 |
5,68 |
7,73 |
10,92 |
13,18 |
15,24 |
16,81 |
|
|
0,5 |
10,50 |
11,70 |
15,00 |
18,98 |
22.16 |
24,77 |
|
|
40 |
0,125 |
3,18 |
4,77 |
6,83 |
8,51 |
9,76 |
10,56 |
|
0,25 |
6,82 |
10,23 |
14,08 |
17,06 |
19,56 |
20,20 |
|
|
0,5 |
13,41 |
16,59 |
20,91 |
24,08 |
27,16 |
29,38 |
|
|
60 |
0,125 |
3,75 |
5,23 |
7,60 |
9,09 |
10,22 |
10,98 |
|
0,25 |
8,86 |
13,64 |
17,61 |
20,56 |
23,18 |
25,24 |
|
|
0,5 |
14,55 |
18,86 |
24,32 |
27,84 |
30,90 |
32,98 |
|
В растворе с концентрацией 0,5 моль/л потери лития и расчетная толщина пленки линейно возрастают во времени.
Коррозионные потери лития в растворах возрастают с увеличением температуры и содержания LiOH для всех исследуемых растворов. Связано это с термодинамической неустойчивостью [LiAl2Cl6]OH при хранении и разложении его с избытком AlCl3. Такие растворы являются кислотами Льюиса и должны растворять пассивную пленку LiCl на поверхности лития, что приводит к возрастанию коррозии лития. С увеличением времени хранения коррозия лития возрастает по параболическому закону для всех исследуемых растворов, что свидетельствует об образовании пассивных пленок на поверхности лития, обладающих защитными свойствами и тормозящими коррозию лития.
Толщину пассивирующей пленки без учета пористости можно рассчитать, используя данные по количеству лития, затраченного на образование пленки. Из общей потери лития нужно вычесть количество лития, ушедшего в раствор. Установлено, что при температуре 20 °С в растворах, содержащих 0,125 и 0,25 моль/л LiOH на образование пассивирующей пленки LiCl лития тратится больше, чем растворяется. В растворе, содержащем 0,5 моль/л наблюдается обратная зависимость – на образование пленки лития уходит меньше, чем растворяется. Аналогичная зависимость сохраняется при температурах 40 °С и 60 °С. В табл. 2 приведены коррозионные потери лития, пошедшие на образование пассивной пленки на поверхности лития и на нейтрализацию AlCl3, образующегося при разложении электролита при хранении.
Таблица 2
Влияние температуры раствора и концентрации LiOH на коррозионные потери лития с учетом образования пассивирующей пленки и разложения электролита Li[Al2Cl6OH] при хранении
|
Тем-пера-тура, °С |
Концентрация LiOH, моль/л |
Время хранения, сутки |
||||||||
|
13 |
60 |
90 |
150 |
|||||||
|
Потери лития, г/м2 |
||||||||||
|
растворение |
обр. пленки |
растворение |
обр. пленки |
растворение |
обр. пленки |
растворение |
обр. пленки |
|||
|
20 |
0,125 |
0,45 |
2,28 |
2,27 |
3,75 |
3,64 |
4,20 |
4,32 |
6,25 |
|
|
0,25 |
1,68 |
4,00 |
4,18 |
6,73 |
5,34 |
7,84 |
7,16 |
8,07 |
||
|
0,5 |
5,23 |
4,47 |
11,13 |
7,85 |
13,64 |
8,52 |
17,16 |
9,77 |
||
|
40 |
0,125 |
0,68 |
2,50 |
2,50 |
4,32 |
– |
– |
4,43 |
6,25 |
|
|
0,25 |
1,48 |
5,34 |
4,55 |
9,54 |
6,25 |
10,80 |
– |
– |
||
|
0,5 |
6,93 |
6,48 |
12,80 |
8,11 |
14,77 |
9,32 |
18,64 |
11,13 |
||
|
60 |
0,125 |
0,80 |
2,96 |
2,84 |
– |
– |
– |
4,55 |
6,59 |
|
|
0,25 |
2,16 |
6,70 |
6,59 |
11,02 |
8,07 |
12,50 |
– |
– |
||
|
0,5 |
7,84 |
6,71 |
15,34 |
13,27 |
17,27 |
10,57 |
20,00 |
13,41 |
||
Полученные данные подтверждают предположение, что в растворах, содержащих LiOH, пассивная пленка на поверхности лития при хранении становится более толстой и пористой и при концентрации LiOH 0,5 моль/л теряет защитные свойства. Реальная геометрическая толщина пленки гораздо больше расчетной. Визуально наблюдали на поверхности литиевого образца после хранения при повышенных температурах очень массивные пленки, которые отрывались и падали на дно ампулы. Расчетная толщина пленки LiCl без учета пористости представлена в табл. 3.
Таблица 3
Зависимость расчетной толщины пленки на литии без учета пористости от концентрации LiOH в растворе Li[Al2Cl6OH], температуры раствора и времени хранения
|
Тем-пера-тура, °С |
Концентрация LiOH, моль/л |
Расчетная толщина пленки, мкм |
||||
|
Время хранения, сутки |
||||||
|
13 |
60 |
90 |
120 |
150 |
||
|
20 |
0,125 |
11,06 |
11,06 |
12,39 |
– |
18,44 |
|
0,25 |
14,08 |
12,81 |
23,14 |
23,81 |
– |
|
|
0,5 |
19,00 |
23,17 |
25,14 |
– |
28,83 |
|
|
40 |
0,125 |
7,38 |
12,75 |
– |
– |
18,94 |
|
0,25 |
15,76 |
28,15 |
31,87 |
34,88 |
– |
|
|
0,5 |
19.12 |
23,93 |
27,50 |
32,84 |
– |
|
|
60 |
0,125 |
8,71 |
14,05 |
– |
– |
19,45 |
|
0,25 |
19,77 |
32,52 |
36,89 |
38,22 |
– |
|
|
0,5 |
19,88 |
26,50 |
31,19 |
– |
39,57 |
|
Выводы
1. Увеличение температуры раствора ведет к возрастанию электропроводности и росту электрохимической коррозии лития. При увеличении температуры возрастает скорость разложения электролита и соответственно увеличивается скорость растворения пассивирующей пленки. Это вызывает активацию химической коррозии лития.
2. С увеличением времени хранения коррозия лития возрастает по параболическому закону для всех исследуемых растворов.
3. Пассивная пленка на поверхности лития при хранении становится более толстой и пористой. При концентрации LiOH 0,5 моль/л теряет защитные свойства.

