Как известно, липопротеины плазмы крови и их белковые компоненты аполипопротеины осуществляют в организме транспорт липидов, витаминов, стероидных гормонов и различных ксенобиотиков [3]. Однако этим функции липо- и аполипопротеинов не ограничиваются. В работах [7, 8, 9, 10] было показано, что аполипопротеин А-I (апоА-I) человека, ассоциированный со стероидными гормонами, специфически взаимодействует как с одноцепочечными, так и двуцепочечными короткими GCС-богатыми олигодезоксирибонуклеотидами, образуя с ними устойчивые комплексы. Была рассчитана и константа диссоциации такого комплекса, составившая ~ 10-6 – 10-5 М–1 [10]. В этой связи несомненный интерес представляет исследование способности апоА-I непосредственно связываться с высокомолекулярными плазмидными ДНК с помощью ИК-Фурье спектрометрии, которая позволяет изучать пробы в водном растворе, причем небольшой концентрации. Учитывая тот факт, что на мембране клеток различных тканей имеются специфические рецепторы для апоА-I, то можно ожидать, что комплексы апоА-I с высокомолекулярными ДНК будут способны проникать внутрь клеток-мишеней, то есть такие комплексы, по существу, будут представлять собой транспортную форму ДНК для её адресной доставки в клетки. Для проверки специфичности связывания апоА-I с ДНК мы исследовали и характер взаимодействия плазмидной ДНК с бычьим сывороточным альбумином (БСА). Выяснению этого вопроса посвящена настоящая работа.
Таким образом, цель настоящей работы – исследование механизма взаимодействия плазмидной ДНК с очищенным белком апоА-I человека и БСА методом ИК-Фурье спектрометрии.
Материалы и методы исследования
Выделение плазмидной ДНК. Плазмидную ДНК pETm-CBD размером 5782 п.н. выделяли методом щелочного лизиса, гидролизовали рестриктазой EcoR1 и экстрагировали фенол-хлороформом с последующим осаждением ДНК 70 % этанолом.
Выделение и делипидирование липопротеинов высокой плотности (ЛПВП).
Липопротеины из сыворотки крови выделяли изоплотностным ультрацентрифугированием в растворах KBr [6]. Зону ЛПВП, состоящую в основном из комплекса апоА-I и липидов, диализовали 5 часов при 4 °С против 3-х смен стократного избытка ФСБ для удаления KBr. Делипидирование ЛПВП осуществляли по методу Cham B.E. и Knowles B.R. [5].
Очистка апоА-I. Последующую очистку апоА-I проводили либо высаливанием сульфатом аммония, либо ионообменной хроматографией. Установили, что оптимальной концентрацией для высаливания апоА-I является 35 % сульфата аммония. Очистку апоА-I высаливанием проводили в два этапа. Сначала белок преципитировали 35 %-ным сульфатом аммония при 4оС в течение 1 часа. Преципитат белка, обогащенный апоА-I, осаждали при 16000xg, затем осадок экстрагировали 30 %-ным сульфатом аммония при интенсивном перемешивании в течение 1 часа при комнатной температуре, переводя в раствор большую часть соосаждённого альбумина и минорных белков.
Высаливание проводили либо непосредственно после делипидирования препарата, либо раствор аполипопротеина и примесных белков предварительно диализовали против 2-х смен стократного избытка ФСБ для удаления бутанола. Во втором случае, после добавления сульфата аммония и центрифугирования, образовывался осадок белка, легко растворимый в ФСБ.
Если же высаливание проводили без предварительного диализа, то преципитаты белка всплывали при центрифугировании вверх в результате образования комплекса апоА-I-бутанол. Полученный таким образом преципитат белка растворялся лишь при добавлении мочевины до концентрации 4-6 М. В дальнейшем от мочевины освобождались диализом по описанной выше схеме, но в течение 24 час.
Очистку выделенного апоА-I осуществляли также методом ионообменной хроматографии на анионообменной смоле YMC-BioPro Q30 (YMC Europe GmbH, Германия). Хроматографию проводили в градиенте NaCl. Установили, что максимальное разделение апоА-I от человеческого сывороточного альбумина (ЧСА) достигается при 200 мМ NaCl.
ИК-Фурье спектрометрия ДНК и её комплексов с апоА-I и БСА. Инфракрасные спектры растворов ДНК снимали на ИК-Фурье спектрометре (Nicolet 6700, Thermo Scientific, USA) методом НПВО (нарушенного полного внутреннего отражения) с использованием алмазной приставки с разрешением 4 см-1 в диапазоне частот 900-4000 см-1, что соответствует длине волны 2,5-11 мкм. Спектры снимали против буфера, содержащего 1 мM (Na2SO3/NaHSO3), pH 7,41. Исследуемые пробы содержали 6 мкл плазмидной ДНК (1 мг/мл) и возрастающие количества апоА-I с исходной концентрацией ~10-9 М: 1 мкл (проба № 1), 2 мкл (проба № 2), 3 мкл (проба № 3), 4 мкл (проба № 4). В нескольких пробах вместо апоА-I вносили БСА (~10-9 М) в количестве 1 мкл (проба № 5), 2 мкл (проба № 6), 3 мкл (проба № 7) и 4 мкл (проба № 8). Контрольная проба содержала только 6 мкл плазмидной ДНК (1 мг/мл). Пробу закрывали фторопластовой крышкой. Оптическую камеру герметизировали и продували сухим воздухом. Время сьемки спектра составляло 30 сек при температуре 22 °С. Снятие и математическую обработку спектров осуществляли с помощью специальной программы OMNIC, прилагаемой к прибору.
Результаты исследования и их обсуждение
Плазмидную ДНК исследовали в буфере, содержащем 1 мM (Na2SO3/NaHSO3), pH 7,4. Обнаружены полосы поглощения 948.8, 974.4 см-1 С-С скелетные колебания, 1044.8 см-1 СОС связь дезоксирибозы, 1088.05 Р=О связь (асимметричные колебания), 1227.5 см-1 Р=О связь (сим. колебания) и полосы поглощения СО связей оснований (1643.9, 1661.9 1696.7 см-1) (рис. 1).
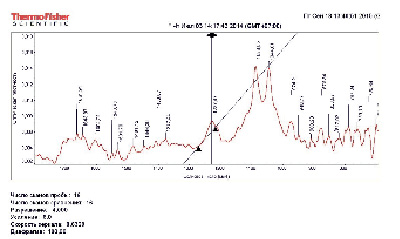
Рис. 1. ИК-спектр плазмидной ДНК (контроль) в буфере, содержащем 1 мM (Na2SO3/NaHSO3), pH 7,4
Полосы поглощения остова. Из рассмотренных полос поглощения обращает на себя внимание отношение интегральной интенсивности полос S1044.8/S1088.05 (рис. 2). Эти полосы поглощения характеризуют поведение остова. Величина S1044.8/S1088.0 в данном случае составляет 1,06. Следует обратить внимание на частоту и интенсивность полос поглощения 948.8, 974.4 см-1 С-С скелетные колебания, 1044.8 см-1 СОС связь дезоксирибозы, 1088.05 Р=О связь (сим. колебания) и 1227.5 см-1 Р=О связь (асим. колебания) (рис. 1).
Анализ пробы № 1. При инкубации плазмидной ДНК с апоА-I наблюдали уменьшение интенсивности полос поглощения 1044.8 см-1 и 1088.05 см-1. Интенсивности полос 1044.8 см-1 и 1088.05 см-1 уменьшились в 2,0 и 1,5 раза, соответственно. Величина отношения S1044.5/S1088.0 в данном случае составила 0,59. Как можно видеть, отличие интенсивности полос и их отношение до инкубации и после инкубации значительное. Наблюдали также сдвиг полос поглощения 974.2 → 970.0 (?ν = 4,2 см-1), 948.8→938.0 (?ν = 10,8 см-1) (С-С скелетные колебания) и 1088.0 → 1085.5 (?ν = 2,5 см-1) (Р=О связь). Валентные колебания Р=О связи отразились в расщеплении полосы на 1214.1 и 1231.8 см-1. Это можно объяснить образованием водородной связи между концевыми NH группами апоА-I и P=O cвязью ДНК.
Валентные колебания СО-связей оснований. После инкубации ДНК с апоА-I в области валентных колебаний СО связей оснований ДНК наблюдали сдвиги полос 1643.8→1649.7 (?ν = 5,9 см-1), 1661.9 → 1667.9 (?ν = 6,0 см-1) и увеличение разрешения полос 1698.8 и 1715 см-1. Кроме того, появилась полоса поглощения 1681.9 см-1. Пиковая интенсивность полосы 1649.7 см-1 увеличилась на 16 %, в то время как интенсивность полосы 1667.9 уменьшилась на 20 % (табл. 1).
Таблица 1
Частота (ν) и интегральная интенсивность (S) полос поглощения ДНК и ее комплексов с белками
|
ДНК (1мг/мл) /контроль/ |
ν 1 СО 1699.4 |
ν2 СО 1678.7 |
ν3 СО 1652.2 |
ν4 NH 1576.2 |
ν5 CN 1456.0 |
ν6 1419.5 |
ν7 P ac. 1238.3 |
ν8 PO ac.1226.4 |
ν9 CC 969.2 |
|
S |
0,004 |
0,001 |
0,002 |
0,001 |
0,0024 |
0,001 |
0,0016 |
0,001 |
0,0035 |
|
Проба № 1 (ДНК + апоА-I) |
1695.2 |
1674.7 |
1645.9 |
1565.7 |
1418.3 |
1224.3 |
969.0 |
||
|
S |
0.003 |
0.0006 |
0.003 |
0.001 |
0.0002 |
0.0065 |
0.0044 |
||
|
Проба № 5 (ДНК + БСА) |
1693.3 |
1639.0 |
1575.3 |
1483.9 |
1226.3 |
974.9 |
|||
|
S |
0.001 |
0.002 |
0.0013 |
0.001 |
0.0055 |
0.002 |
Примечание. Точность измерения частоты (ν) и интегральной интенсивности (S) составляет ± 0.5 и ± 0.0005, соответственно.
Как видно из спектров после инкубации ДНК с апоА-I количество полос в области СО и NH (деформационные колебания) больше, чем в исходном спектре ДНК.
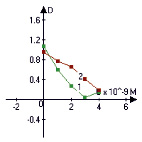
Рис. 2. Отношение интегральной интенсивности полос поглощения 1045.7/1085.0 в зависимости от концентрации белков (1 – апоА-I; 2 – БСА) в ДНК-содержащей пробе
Анализ пробы № 2. При увеличении в пробе № 2 количества апоА-I в 2 раза, по сравнению с пробой № 1, наблюдали еще большее уменьшение интенсивности полосы поглощения 1044.8 и ее сдвиг на 4,4 см-1 в коротковолновую область. Отношение интегральной интенсивности полос S1049,3/S1086,2 cоставило 0,27. Это отношение явно меньше, чем в спектре контрольной ДНК и в спектре ДНК пробы № 1. Следует отметить и уменьшение интенсивности многих полос в этой области спектра, тогда как интенсивность полосы поглощения 1112.6 см-1 увеличивается. Полагаем, что это полоса Р=О группы, образовавшаяся как результат формирования водородной связи с апоА-I.
Валентные колебания СО-связей оснований. В области валентных колебаний СО связей оснований ДНК в данном случае частотные сдвиги небольшие – в пределах 0,5-1.0 см-1. То же самое можно сказать о деформационных колебаниях NH связей. Однако интенсивность всех этих полос уменьшилась вдвое.
Анализ пробы № 3. При увеличении в пробе № 3 количества апоА-I в 3 раза, по сравнению с пробой № 1, полоса поглощения 1044.8 см-1 стала едва заметной и появилась полоса 1031.6 см-1. Отношение интегральной интенсивности S1053,3/S1086,4 составило величину 0,04. Как можно видеть, она существенно уменьшилась по сравнению с предыдущими результатами (табл. 2 и рис. 3). У полосы поглощения 1227.7 см-1 появилась полоса в коротковолновой области в отличие от исходного спектра ДНК.
Таблица 2
Отношение интегральной интенсивности полос поглощения 1045.7/1085.0
|
ДНК (1мг/мл) /контроль/ |
Проба № 1 |
Проба № 2 |
Проба № 3 |
Проба № 4 |
|
1.06 |
0.59 |
0.27 |
0.04 |
0.13 |
|
ДНК (1мг/мл) /контроль/ |
Проба № 5 |
Проба № 6 |
Проба № 7 |
Проба № 8 |
|
0.95 |
0.77 |
0.65 |
0.41 |
0.18 |
Примечание. Точность измерения отношение интегральной интенсивности полос поглощения S1044.8/S1088.05 = ± 0.01.
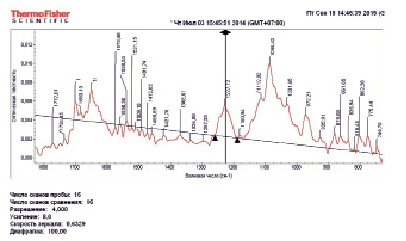
Рис. 3. ИК-спектр пробы № 3, содержащей смесь плазмидной ДНК (1 мг/мл) и 3 мкл раствора 10-9 M апоА-I в 1 мM (Na2SO3/NaHSO3) – буфере, pH 7,4
Валентные колебания СО связей оснований. Интенсивность полосы 1649.5 см-1 увеличилась относительно других полос в этой области. Также хорошо проявилась полоса 1699.7 см-1, в то время как в спектре контрольной ДНК она была слабой. Создается впечатление, что поскольку исходная, контрольная ДНК более упорядочена, то и основания имеют менее выраженные полосы поглощения в области 1500-1700 см-1. Анализ этих спектров позволяет утверждать, что процесс плавления (разупорядочивания) при указанной концентрации апоА-I продолжается (табл. 1 и рис. 3).
Анализ пробы № 4. При увеличении в пробе № 4 количества апоА-I в 4 раза, по сравнению с пробой № 1, полоса поглощения 1086.9 сдвинулась незначительно относительно этой же полосы в предыдущей пробе (?ν = 0,5 см-1), но интенсивность ее немного увеличилась. Увеличилась и интенсивность полосы поглощения 1044.8 см-1. Отношение интегральной интенсивности полос поглощения S1052,0/S1086,5 в этом случае составило 0,13. Наблюдали также сдвиг полос поглощения 974.2 → 969.5 (?ν = 4,7 см-1) и 1227.5 → 1222.3 (?ν = 5,2 см-1), и их расщепление (табл. 1, 2 ).
Валентные колебания СО связей оснований. В области поглощения оснований (СО связь) были зарегистрированы полосы поглощения, мало отличающие по частоте (1643.1, 1662.0). Однако, интенсивность этих полос поглощения стремится к восстановлению. Это же характерно для полос поглощения, относящихся к остову (1086.9, 1222.3 и 969.5). Эти результаты свидетельствуют о том, что достигнуто насыщение по количеству апоА-I в пробе с ДНК. Процесс плавления ДНК прекратился, и далее наблюдался аддитивный эффект ДНК+апоА-I.
Анализ пробы № 5. Для выявления специфичности взаимодействия апоА-I с ДНК мы сравнивали его со взаимодействием БСА с ДНК. Схема проведения эксперимента была аналогичной, описанной для пробы № 1. При анализе пробы № 5 наблюдали сдвиг частот полос поглощения 1085.9 → 1084.0 (?ν = 1,9 см-1) и 1045.8 → 1047.2 (?ν = 1,4 см-1), 1217.75 → 1221.65 (?ν = 4,1 см-1) и 971.4→973.0 (?ν = 1,6 см-1) (табл. 1). Отношение интегральной интенсивности полос S1045,0/S1084,6 составило величину 0,77 (табл. 2).
Валентные колебания СО связей оснований. В области оснований ДНК, ненагруженной БСА, наблюдались более интенсивные полосы поглощения 1641.5, 1656.0, 1673.4, 1696.7 см-1 и 1699.2 см-1 (табл. 1).
Анализ пробы № 6. При увеличении в пробе № 6 количества БСА в 2 раза, по сравнению с пробой № 5, обнаружили сдвиг полос 1085.9 → 1084.3 (?ν = 1,6 см-1) и 1045.8 → 1046.9 (?ν = 1,1 см-1), 1217.75 → 1225.3 (?ν = 7,55 см-1) и 971.4 → 963.0 (?ν = 8,4 см-1) (табл. 1). Сдвиги полос поглощения РО связей (1217.75 см-1) и 971.4 см-1 (С-С скелетные кол.) значительно больше, чем в пробе № 5. Отношение интегральной интенсивности полос поглощения S1046,9/S1084,3 составило величину 0.57 (табл. 2). Увеличилась интенсивность полосы 1123.1см-1. Результаты по указанным полосам существенно отличаются при увеличении содержания БСА в ДНК.
Валентные колебания СО связей оснований. В области оснований ДНК, ненагруженной БСА, более выражены по интенсивности полосы поглощения 1641.5, 1673.4 и 1696.7 см-1. В пробе № 6, по сравнению с пробой № 5, более выражены полосы поглощения 1643.5 и 1701.2 см-1.
NH деформационные колебания. В контрольной пробе ДНК следует выделить полосы поглощения 1486.4 СN колебания и 1531.4 см-1. В пробе № 6 наблюдаются полосы поглощения 1482.7, 1532.8 и 1578.3 см-1, причём возросла интенсивность полосы поглощения 1578.3.
Анализ пробы № 7. При анализе пробы № 7 обнаружили сдвиг полос 1085.9→1083.1 (?ν = 2,8 см-1) и 1045.8 → 1045.4 (?ν = 0,4 см-1), 1217.75 → 1226.3 (?ν = 8,55 см-1) и 971.4 → 974.9(?ν = 3,5 см-1). Отношение интегральной интенсивности полос поглощения S1047,2/S1083,1 составило величину 0,37 (табл. 2, рис. 4.). Как можно видеть, интенсивность полосы поглощения 1047.2 относительно полосы 1083.1 см-1 уменьшилась более заметно, чем в случаях проб № 5 и № 6.
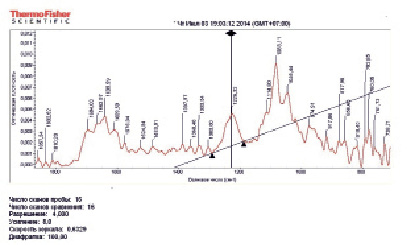
Рис. 4. ИК-спектр пробы № 7, содержащей смесь плазмидной ДНК (1 мг/мл) и 3 мкл раствора 10-9 M БСА в 1 мM (Na2SO3/NaHSO3) – буфере, pH 7,4
Валентные колебания СО связей оснований. В области оснований ДНК, ненагруженной БСА, как и в случае пробы № 6, более выражены по интенсивности полосы поглощения 1641.5, 1673.4 и 1696.7 см-1. В ИК-спектре пробы № 7 более выражены полосы поглощения 1640.0 и 1694.6 см-1.
NH деформационные колебания.
В контрольной пробе ДНК в ИК-спектре следует выделить полосы поглощения 1486.4 СN и 1531.4 см-1 NH cвязи. В пробе № 7 наблюдаются полосы поглощения 1483.9, 1524.3, 1553.9 и 1578.3 см-1. Итак, в этой пробе полоса поглощения 1531.4 сдвинулась на 6.9 см-1 в длинноволновую область и появилась полоса 1553.9 см-1 (рис. 4).
Анализ пробы № 8.
В пробе № 8 отношение интегральной интенсивности полос поглощения 1045.7/1085.0 составило 0.26.
Заключение
Инкубация плазмидной ДНК с апоА-I приводит, по-видимому, к изменению вторичной структуры макромолекулы, поскольку сопровождается изменением конформации дезоксирибозы, частоты и интенсивности полос поглощения P=O, POC, NH, CC. Изменение частоты ряда этих полос связано с образованием водородных связей. По совокупности данных, полученные результаты можно интерпретировать как плавление ДНК при связывании с апоА-I или как структурный переход типа порядок-беспорядок.
Анализ изменения отношения интегральной интенсивности полос поглощения 1045.7/1085.0 при инкубации плазмидной ДНК с апоА-I и с БСА свидетельствует о более глубоком плавлении ДНК при взаимодействии с апоА-I, причем в области небольших концентраций белка (10-9 – 3х10-9 М). Это указывает, с одной стороны, на более высокое сродство апоА-I к ДНК по сравнению с БСА, с другой – на возможное участие апоА-I в регуляции экспрессии генов на уровне транскрипции [1, 2, 4, 8-10].

