Ненасыщенные и ароматические производные аденина обладают широким спектром фармакологической активности, среди соединений этого ряда обнаружены мощные ингибиторы вирусной репродукции, активные в отношении ВИЧ-1 [7] и цитомегаловируса человека [8]. У некоторых веществ были также выявлены выраженные психотропные, в частности, антидепрессантные и противострессорные свойства [2, 3]. Согласно вычислительному прогнозу биологической активности, эти соединения могут обладать высоким сродством к разнообразным пуриновым рецепторам [6], что проливает свет на молекулярный механизм их фармакологического действия.
Цель исследования. Синтез различных 9-замещенных производных аденина, содержащих ненасыщенные и ароматические фрагменты в составе заместителя, и исследование их влияния на индуцированную аденозиндифосфатом (АДФ) агрегацию тромбоцитов in vitro.
Материалы и методы исследования
Синтез новых производных аденина был осуществлен путем N9-алкилирования аденина тозилатами моноэфиров этиленгликоля и ароматическими глицидиловыми эфирами в среде безводного диметилформамида в присутствии карбоната калия при температуре 105–110 °С, как это описано нами ранее для других нуклеиновых оснований [4, 5]. Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D6, внутренний стандарт – тетраметилсилан. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
Фенилглицидиловый эфир. К раствору 40,0 г (0,425 моль) фенола и 25,0 г (0,425 моль) 95 %-ого калия гидроксида в 100 мл воды добавляют при начальной температуре 20–25 °С 40,0 мл (0,511 моль) свежеперегнанного эпихлоргидрина и интенсивно перемешивают в течение 30 мин, постепенно повышая температуру раствора до 90–95 °С. После достижения указанной температуры реакционную массу перемешивают еще 15 мин, охлаждают до комнатной температуры, добавляют 100 мл бензола, органический слой отделяют, промывают 100 мл воды, сушат сульфатом натрия, фильтруют и упаривают на кипящей водяной бане в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию с Ткип 130–135 °С (10 мм рт. ст.), и получают 51,7 г (81 %) фенилглицидилового эфира в виде вязкой бесцветной жидкости, n20D 1,5312.
(R,S)-9-(3-Фенокси-2-окси-1-пропил)аденин (V). Смесь 1,5 г (11,1 ммоль) аденина и 2,5 г (18,1 ммоль) свежепрокаленного карбоната калия перемешивают в течение 30 мин при температуре 105–110 °С в 40 мл безводного диметилформамида, добавляют раствор 1,7 г (11,3 ммоль) фенилглицидилового эфира в 10 мл диметилформамида и перемешивают при той же температуре в течение 1 ч. Охлаждают, фильтруют, фильтрат упаривают в вакууме, остаток дважды кристаллизуют из изопропилового спирта и получают 2,2 г (69 %) V в виде светло-желтого кристаллического вещества, Тпл 169–172 °С.
Спектр ЯМР 1Н, δ, м. д.: 3,92–4,00 м (2Н, N–CH2); 4,21–4,32 м (2Н, О–СН2); 4,37–4,45 м (1Н, СН); 5,59 уш. с. (1Н, ОН); 6,82–7,00 м (3Н, фенил); 7,20–7,32 м (4Н, фенил, NH2); 8,10 с (1Н, Н8); 8,18 с (1Н, Н2).
Спектр ЯМР 13С, δ, м. д.: 46,77; 67,52; 70,26; 114,84; 118,98; 121,07; 129,60; 141,98; 150,07; 152,68; 156,29; 158,74.
Исследование антиагрегантной активности проводили на модели АДФ-индуцированной агрегации тромбоцитов, основанной на регистрации степени изменения светопропускания плазмы, богатой тромбоцитами [1]. Эксперименты были выполнены на 10 кроликах массой 2,5–3,5 кг, содержавшихся в условиях вивария с естественным световым режимом на стандартной диете в соответствии с ГОСТ ИСО/МЭК 17025-2009 и ГОСТ Р ИСО 5725-2002 с соблюдением «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях».
Результаты исследования и их обсуждение
В результате проведенных исследований установлено, что аденин-основание с достаточно высоким выходом алкилируется тозилатами монозамещенных гликолей и фенилглицидиловыми эфирами в среде безводного диметилформамида в присутствии избытка карбоната калия по схеме, изображенной на рисунке.
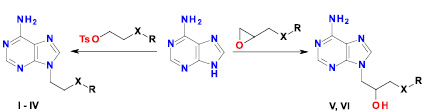
где X = O, S; R = аллил, фенил, п-хлорфенил, п-изопропилфенил.
Схема синтеза 9-фенил(аллил)окси(тио)алкилпроизводных аденина
При этом использование в качестве алкилирующих агентов фениловых эфиров глицидола обеспечивает несколько более высокий выход целевых продуктов (64–69 %) по сравнению с толуолсульфонатами (54–57 %) (таблица). Полученные производные аденина представляют собой белые кристаллические вещества, мало растворимые в воде, растворимые в спирте и диметилсульфоксиде. Химическое строение всех новых веществ доказано ЯМР-спектроскопией.
Выход, физико-химические свойства и антиагрегантная активность синтезированных соединений
|
Соединение |
X |
R |
Выход, % |
Тпл, °С |
Ингибирование агрегации (10–4 М), % |
|
I |
O |
аллил |
57 |
139–142 |
35,0 |
|
II |
O |
п-хлорфенил |
54 |
199–202 |
19,6 |
|
III |
O |
п-изопропилфенил |
55 |
231–233 |
21,9 |
|
IV |
S |
п-хлорфенил |
41 |
174–176 |
18,3 |
|
V |
O |
фенил |
69 |
169–172 |
38,4 |
|
VI |
O |
п-хлорфенил |
64 |
201–204 |
25,6 |
|
Ацетилсалициловая кислота |
52,1 |
||||
При исследовании антиагрегантной активности синтезированных 9-замещенных производных аденина было установлено, что все они в той или иной степени обладают выраженной способностью в концентрации 10–4 моль/л ингибировать агрегацию тромбоцитов, вызванную АДФ в конечной концентрации 5?10–6 моль/л, уступая, однако, по величине антиагрегантного эффекта ацетилсалициловой кислоте. При этом, не зависимо от строения цепи, соединяющей гетероциклическую пуриновую систему и ароматическое ядро, введение дополнительных заместителей в пара-положение бензольного кольца (хлор, изопропил) приводит к существенному (в 1,5–2 раза) ослаблению антиагрегантного действия. Замещение атома кислорода на серу в составе линкера (соединения II и IV) практически не влияет на антиагрегантные свойства веществ. Наиболее высокую антиагрегантную активность на использованной модели продемонстрировало соединение V – (R,S)-9-(3-фенокси-2-окси-1-пропил)аденин, представляющий интерес для дальнейших фармакологических исследований.
Заключение
Осуществлен синтез новых производных аденина, содержащих ненасыщенные и ароматические фрагменты в качестве заместителей в положении N9 пуриновой гетероциклической системы. Исследование антиагрегантных свойств новых веществ выявило наличие у них выраженной способности ингибировать агрегацию тромбоцитов плазмы кролика, вызванную индуктором агрегации АДФ. Полученные результаты позволяют считать целесообразным синтез новых структурных аналогов соединений изученного ряда с целью разработки на их основе эффективных лекарственных средств для лечения нарушений системы кровообращения.

