Оптические излучения будучи биологически активными факторами внешней среды организма привлекают все более пристальное внимание ученых. Повышенный интерес обусловлен тем, что трансфузия аутологичной крови, облученной оптическим излучением, может оказывать мощное терапевтическое действие на различные патологические состояния человека и животных [5, 11, 12]. Значимость приобрели исследования механизмов действия оптических излучений на патогенез опухолей. Фотомодификация крови проводилась преимущественно с помощью ультрафиолетового или низко интенсивного лазерного излучения [3, 4]. В тоже время известно, что низкоэнергетическое некогерентное светодиодное излучение в красном диапазоне спектра относится к числу перспективных и информационно значимых средств для коррекции состояния регуляторных систем живого организма, стимулирующих естественные механизмы гибели опухолевых клеток [10, 14], а также средств способных повышать противоопухолевую эффективность циклофосфана в эксперименте [12]. В связи с этим, целью настоящего исследования явилось изучение некоторых клеточных и системных показателей резистентности организма для патогенетического обоснования эффективности противоопухолевого влияния циклофосфана введенного на модифицированной красным светодиодным излучением (СДИ) аутокрови у животных с опухолью легких.
Материалы и методы исследования
Опыты проведены на 40 белых лабораторных крысах – самцах, массой 250 г. Содержание и использование животных осуществлялось в соответствие с «Правила лабораторной практики», установленным приказом МЗСР РФ № 708н от 23.08.10 и «Правилами проведения научных исследований с использованием экспериментальных животных» в соответствии с регламентом распоряжения Президиума АН СССР № 120002496 от 02.04.80 г. Для моделирования опухоли в легком всем животным была перевита взвесь клеток саркомы 45 в подключичную вену в объеме 0,5 мл изотонического раствора NaCl, содержащей 2 млн опухолевых клеток [8]. Использовали штамм опухоли, полученный из Онкологического Центра АМН России г. Москва. Опыты начинали на третью неделю после перевивки. Животных делили на две группы по 20 в каждой. В первой группе получали кровь из подключичной вены в пробирки в количестве 0,3 см3, добавляли такое же количество глюгицира и облучали СДИ. Через 20 мин добавляли циклофосфан (ЦФ) в дозе 40 мг/кг и инкубировали 40 мин при Т = 37°С, затем реинфузировали в подключичную вену. Противоопухолевую терапию проводили дважды с интервалом 7 дней. СДИ воздействие выполнялось экстракорпорально с помощью светодиода красного света с λ = 0,67 мкм, полученного от аппарата «Спектр ЛЦ», дозой W = 3,06 Дж/см2. Излучение подавалось в непрерывном режиме. Во второй группе контроля наблюдались животные с ростом опухоли без воздействия. Через неделю после последнего введения (соответствует четырем неделям от перевивки с45) половину животных усыпляли и декапитировали, оставшуюся половину животных усыпляли и декапитировали после второго введения (соответствует шести неделям от перевивки). Животные взвешивались на электронных весах (Ohaus Adventurer AR 5120), определялась абсолютная масса внутренних органов. Относительная масса внутренних органов (К) рассчитывалась как отношение массы тела к абсолютной массе органа. При этом отмечалось наличие макроскопических изменений. Изучали показатели неспецифических адаптационных реакций, индексы интоксикации [6,7]. После вскрытия легкие извлекали, подчитывали количество и диаметр опухолевых узлов. Для морфологического исследования брали опухоль и образцы из верхней и нижней доли правого и левого легкого, фиксировали в 10 %-ном растворе нейтрального формалина, подвергались стандартной спиртовой и ацетоновой проводке, после чего доводились до парафиновых блоков. Срезы толщиной 6–8 мкм окрашивались гематоксилином и эозином. Микроскопию осуществляли в проходящем свете при увеличении х10, х100 (Leica DM LS2).
Проводили цитохимическое исследование катионных белков (кб) с помощью лизосомально-катионного теста (ЛКТ) в мазках крови. Для этого в препаратах крови, окрашенных прочным зеленым-азуром А, определяли средний цитохимический коэффициент (ЦХК) по методу Астольде и Верге (в у.е.) [7]. В каждом препарате подсчитывали не менее 100 клеток. Изучали показатели неспецифических адаптационных реакций по сигнальным критериям лейкограммы Шиллинга, индексы интоксикации [8, 9]. Перед статистической обработкой результатов сначала выясняли характер распределения изучаемых признаков при помощи построения полигона частот. В нашем случае распределение изучаемых признаков соответствовало нормальному, гауссовскому. Статистическую обработку проводили с помощью компьютерной программы «Statistica 6.0» использованием t критерия Стьюдента (р < 0,05).
Результаты исследований и их обсуждение
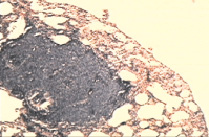
В контрольной группе через четыре недели от момента перевивки опухоли было обнаружено поражение легких множественными опухолевыми узлами (рис. 1, а), размером 0,5–1,0 см на фоне крупных очагов кровоизлияния в органе. Опухолевая инвазия была выявлена в межальвеолярных перегородках, в основных респираторных структурах, в том числе и бронхиолах. Микроскопическая картина саркомы 45 была представлена клетками опухоли веретиновидной формы, плотно расположенными относительно друг друга, межклеточное пространство было слабо выражено. Ядра опухолевых клеток округлые, крупные с несколькими ядрышками. Цитоплазма относительно небольшого объема. Определяли множество клеток с различными фигурами патологических митозов.
а б
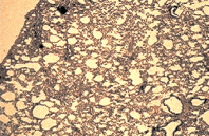
Рис. 1. а – крупный опухолевый узел С45 в легком контрольной группы (через 4 недели от перевивки).Окраска гематаксилином и эозином. Микрофотография, ув. х10; б – регрессивные изменения опухолевых узлов в группе с ЦФ + СДИ (через 6 недель от перевивки). Окраска гематаксилином и эозином. Микрофотография, ув. х10
В ткани легких зафиксированы изменения по типу вентиляционно-циркуляторных расстройств. Микроскопические изменения ткани легких были представлены обширными участками ателектаза и дисателектаза. Просветы альвеол были резко сужены и на некоторых участках, представляли собой узкие щели. Рядом с такими зонами наблюдались очаги резкого вздутия легочной ткани, которые проявлялись расширением просвета альвеол и истончением межальвеолярных перегородок, вплоть до их разрыва. В просветах альвеол – отечная жидкость, эритроциты, десквамированные альвеоциты. Просветы терминальных и респираторных бронхиол резко расширены. Нарушение микроциркуляции сопровождалось развитием резкого повышения проницаемости стенки сосудов с развитием диффузной геморрагической инфильтрации в межальвеолярных перегородках и выраженным интерстициальным отеком. Просветы сосудов расширены, в капиллярах межальвеорярных перегородок и в мелких ветвях легочной артерии отмечаются явления стаза, диапедеза эритроцитов и других форменных элементов крови в соединительную ткань. В просветах бронхов среднего и мелкого калибра выявляются макрофаги, слизь и слущенные клетки мерцательного эпителия. Многорядный мерцательный эпителий с собственной пластинкой слизистой оболочки образуют сосочковые выросты в полости бронхов. В этих участках эпителиальные клетки характеризуются картинами дискариоза, гипо- и гиперхроматоза. Мерцательные клетки лишены ресничек. Высота эпителия бронхов среднего калибра варьирует, местами встречаются участки однослойного плоского эпителия. Мышечная пластинка слизистой оболочки бронхов утолщается за счет гипертрофии гладкомышечных клеток. Ядра миоцитов также гипертрофируются, в них отмечается гипо-, гиперхроматоз и глубокие двусторонние амитотические перешнуровки.
В опытной группе в этот период времени развитие опухолевого процесса после фотомодифицированной химиотерапии на аутокрови, сопровождалось менее выраженными патоморфологическими изменениями. Число и размеры опухолевых узлов были достоверно ниже (табл. 1).
Таблица 1
Характеристика опухоли легких на этапе эксперимента (M ± m)
|
Группы (по n = 10) |
Масса тела, гр. |
Число опухолевых узлов, ед. |
Размеры опухолевых узлов, мм |
|
4 недели от перевивки (через неделю после первой химиотерапии) |
|||
|
Контроль |
200,0 ± 7,4 |
4,2 ± 1,2 |
1,3 ± 0,7 |
|
ЦФ + СДИ |
203,9 ± 9,5 |
1,5 ± 0,1* |
0,3 ± 0,02* |
|
6 недель от перевивки (через две недели после второй химиотерапии) |
|||
|
Контроль |
189 ± 5,2 |
10 ± 1,2 |
5,6 ± 1,2 |
|
ЦФ + СДИ |
200,3 ± 3,5* |
нет |
нет |
Примечание. * – достоверно по отношению к контролю, при р ≤ 0,05.
При микроскопическом анализе в ткани легких определялись отдельные очень мелкие узлы, отмечалось их раздробление путем проникновения внутрь опухолевого узла тяжей рыхлой волокнистой соединительной ткани, инфильтрированной небольшим количеством лимфо-гистиоцитарных элементов. Определялись участки фиброза и некроза в опухоли. Признаки структурной инволюции саркомы 45 состояли в утрате большинством клеток саркомы характерной веретенообразной формы и расширении размеров межклеточного пространства. В опухолевых клетках были зафиксированы дистрофические изменения, проявляющиеся в наличии крупных вакуолей в цитоплазме, в ядрах – гипохромия или беспорядочно сформированная хроматиновая сеть, в некоторых клетках определяли кариорексис, кариолизис.
Микроскопические исследования ткани легких показали наличие незначительных эмфиматозных очагов и некоторое истончение межальвеолярных перегородок, дистелектазы встречались значительно реже, чем в контроле, в основном в перибронхиальных и периваскулярных зонах. Интестициальный отек сохранялся. Расстройства кровообращения были менее выражены, чем в контроле. Очаговые кровоизлияния определялись реже и в меньшей степени. В просветах бронхов среднего и мелкого калибра также выявлялись в незначительном количестве макрофаги, слизь и слущенные клетки мерцательного эпителия.
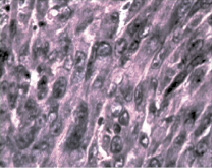
В контрольной группе через шесть недель от момента перевивки опухоли в легких отмечалось массивное разрастание опухоли (рис. 2, а). Отмечались как крупные узлы, с тонкой капсулой, в центральных прикорневых участках, так и диффузный инфильтративный рост во все структуры легкого с мелкими некротическими зонами. Клетки опухоли плотно прилегали друг к другу с отсутствием межклеточного пространства, имели веретеновидную форму. Ядра крупные пузырьковидные с глыбчатым хроматином и ядрышками, цитоплазма отчетливо базофильна. Определялось большое число митозов (до 10–12 в поле зрения). Все эти признаки указывают на активную пролиферацию опухоли. В отдельных участках отмечалась гиперплазия соединительной ткани, образующий многорядный слой фибробластов и гистиоцитов. Вероятно, этот процесс можно оценить, как построение опухолевыми клетками собственной стромы за счет легкого организма хозяина. Такие участки опухоли были окружены кольцом лимфоцитов и макрофагов. В опухоли наблюдались обширные поля кровоизлияний, за счет аррозии сосудов, вследствие нарушения их целостности.
а б
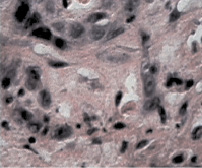
Рис. 2. а – контрольная группа (6 недель от перевивки). Все структуры легкого поражены опухолью. Окраска гематоксилином и эозином. Микрофотография. Ув. 200; б – через две недели после второй фотомодифицированной химиотерапии (6 недель от перевивки). Разрозненные аморфные мелкие группы или единичные, утратившие веретеновидную форму, напоминающие «тени» опухолевые клетки. Окраска гематоксилином и эозином. Микрофотография. Ув. 200
Сформированные опухолевые узлы сдавливали и разрушали собственную легочную ткань животного. Встречаются довольно крупные фокусы ателектазов. Бронхи и бронхиолы в состоянии спадения, в их просвете слизисто-геморрагическая жидкость с примесью слущенного эпителия. Гипертрофия альвеол не наблюдалась, просветы альвеол сужены. Часть альвеол находится в спавшем состоянии (видимо за счет нарушения в системе сурфактанта), в других определяется белковая жидкость (транссудат), что свидетельствует о явлении отека легкого. Полиморноцитарные инфильтраты увеличились в размерах, состоят из лимфоцитов, макрофагах, нейтрофилах, плазматических клетках, эозинофилах. Присутствие эозинофилов указывает на сенсибилизацию организма животного. В очаги воспаления активно мигрируют фибробласты. В стенках бронхов, артериях и интерстиция увеличивается количество коллагеновых волокон, что свидетельствует о признаках фиброза легкого и снижения общей дыхательной поверхности. Расстройства кровообращения на микроциркуляторном уровне проявляются в стазах и плазматизации капилляров, в некоторых случаях развивалось малокровие и запустивание сосудов. Сходные морфологические изменения были описаны другими авторами при росте опухоли с45 при внутривенной перевивки опухоли [13].
В опытной группе через две недели после второй химиотерапии, модифицированной красным светом (соответственно через шесть недель от момента перевивки опухоли), опухолевые узлы в легких не определялись (рис. 1, б). При микроскопическом анализе паренхимы легких определяли широкие поля, образованные лизированным материалом опухоли, а также разрозненные аморфные мелкие группы или единичные, утратившие веретеновидную форму, напоминающие «тени» опухолевые клетки (рис. 2, б).
В таких клетках определяли распыление ядерного хроматина, характеризующего распад геномной основы опухоли. На фоне этого в ткани легкого определялось большое количество лейкоцитов и отдельно лежащих полиморфных голых ядер, располагающихся на участках разрастания молодой соединительной ткани. Микроскопические изменения ткани легких были представлены единичными участками ателектаза и эмфизематозно расширенных альвеол. Стенки межальвеолярных перегородок утолщены, но без обширной лимфогистоцитарной инфильтрации. На этом фоне со стороны бронхиального дерева особых гистологических изменений не определялось. Наблюдалась пролиферация эпителиальных клеток бронхов среднего калибра с образованием однослойного плоского кубического эпителия, который на некоторых участках переходил в однослойный однорядный призматический, а затем в однослойный многорядный мерцательный, что свидетельствовало о восстановлении мерцательного эпителия в бронхиальном дереве. Выраженных патологических структурных изменений со стороны микроциркуляторного русла не наблюдались, просвет капилляров был заполнен форменными элементами крови, в основном эритроцитами и единичными нейтрофилами. Определяется незначительный периваскулярный отек. Несколько более выраженные изменения этого плана дифференцируются в субплевральных зонах. Здесь же встречаются и эмфизематозно измененные фокусы (по-видимому, носящие компенсаторный характер).
Оценка показателей неспецифических адаптационных реакций после окончания лечения у животных позволила установить достоверное различие всех показателей (Р < 0,05) (табл. 2).
Таблица 2
Некоторые показатели неспецифической резистентности на разных сроках опыта, полученные во время забоя (M ± m)
|
Показатели |
4 недели от перевивки (через неделю после первой химиотерапии) |
6 недель от перевивки (через две недели после второй химиотерапии) |
||
|
Опытная группа n = 10 |
Контрольная группа n = 10 |
Опытная группа n = 10 |
Контрольная группа n = 10 |
|
|
Масса тимуса на 100 г массы животных, мг |
167,1 ± 3,4 * |
110 ± 15,4 |
223,1 ± 3,4 * |
76,8 ± 2,3 |
|
Масса надпочечника на 100 г массы животного, мг |
17,4 ± 0,1* |
35,2 ± 3,1 |
14,9 ± 2,3 |
16,5 ± 1,3 |
|
Коэффициент отношения массы тимуса к массе надпочечника, (К) |
9,5 ± 2,6* |
3,1 ± 0,7 |
14,8 ± 2,2* |
2,8 ± 2,4 |
|
Кровоизлияния в желудке и кишечнике |
Не обнаружены |
Есть |
Не обнаружены |
Есть |
|
Лимфоциты периферической крови, % |
78 ± 1,1* |
98,4 ± 1,3 |
62,8 ± 4,7* |
18,4 ± 1,3 |
|
Число лейкоцитов в 1 мл³ крови |
12000 ± 108* |
18000 ± 318 |
10266 ± 113* |
3336 ± 59 |
|
Индекс интоксикации по Кальф-Калифу |
2,7 ± 0,3* |
0,97 ± 0,1 |
3,1 ± 0,1* |
0,18 ± 0,02 |
|
Показатели катионных белков нейтрофилов крови, у.е. |
2,93 ± 0,1* |
0,94 ± 0,1 |
1,59 ± 0,1*ь |
0,28 ± 0,05 |
|
Тип адаптационной реакции |
активация |
стресс |
активация |
стресс |
Примечание. * – достоверно по отношению к контролю, при р ≤ 0,05.
Так через неделю после первой фотомодифицированной химиотерапии в опытной группе масса тимуса превышала значения контроля в 1,5 раз, а через шесть недель после второй модифицированной химиотерапии уже в 2,9 раза, масса надпочечников в контроле была выше в 2 раза, после второй химиотерапии в 1,8 раз. Коэффициенты соотношения массы тимуса и надпочечников (К), косвенно отражающие уровень сбалансированности двух важных подсистем организма – иммунной и эндокринной, были самыми низкими в контрольных группах (в 3,1 раза после первого забоя, и в 5,2 раза после второго). Кровоизлияние в желудочно-кишечном тракте были обнаружены только в контрольных группах. Содержание лейкоцитов в периферической крови было патологически высоким, так при росте опухоли в 1,5 раз выше, чем после первой химиотерапии; отмечали лимфоцитоз (в контроле в 1,3 раза выше число лимфоцитов). На последних этапах опыта, после второго забоя, в контроле отмечали выраженную лейкопению и лимфоцитопению (число лейкоцитов в 3,1 раза меньше опытной группы, а лифоцитов соответственно меньше в 3,4 раза).
Лейкоцитарный индекс интоксикации (ЛИИ) Кальф-Калифа, может рассматриваться как один из интегральных показателей состояния иммунитета у организма, содержащего опухоль. ЛИИ представляет собой отношение процентного содержания суммы клеток нейтрофильного ряда к сумме процентного содержания остальных клеток [6]. Нормальные показатели ЛИИ составляют от 1 до 3 у.е. [6, 7]. Показатель индекса интоксикации в контроле на обоих сроках забоя имел низкие значения до единицы, в опытной группе значения ЛИИ приближались к двум. Таким образом, значения ЛИИ в контроле подтвердили наличие в организме животных с ростом опухоли в легком воспалительных, деструктивных процессов, разной степени выраженности, а также снижение противоопухолевого иммунитета. В то же время в опытной группе показатели ЛИИ были высокие, что свидетельствовало о высоком функциональном потенциале нейтрофильного ряда. Эти данные хорошо согласовались с показателями лизосомального теста по определению катионных белков (КБ) в гранулоцитах крови. Значения КБ высокие в опытной группе и превышали значения КБ контроля на первом сроке опыта в 3,1 раза, а на втором сроке опыта в 5,7 раз. Обращал на себя тот факт, что после первой химиотерапии значения КБ были в 1,8 раз выше, чем на заключительных этапах опыта. Исследование внутригрупповой структуры адаптационных реакций выявило высокую частоту развития у животных опытной группы на всех этапах эксперимента реакций антистрессорного типа, по определению Л.Х. Гаркави – активации (81 %). В группах контроля доминировала стрессорная реакция (98 %).
Известно, что оптическое излучение красного спектра избирательно поглощается молекулой церулоплазмина, цитохромоксидазы, цитохрома, супероксиоксидазы, каталазы [1, 2]. Это приводит к стимуляции клеточного дыхания и антиоксидазной системы перекисного окисления липидов, приводит к уменьшению токсических метаболитов кислорода и свободных радикалов, находящихся в воспалительном очаге [4, 5, 15], что и способствует разрешению инфильтративно-экссудативных процессов в очаге воспаления и ускорению репарации и пролиферации неповрежденной ткани легких. Ранее было показано при изучении изменений содержания нуклеиновых кислот (ДНК, РНК) в ядрах клеток различных тканей, в том числе и клетках крови под действием чрез кожу низкоэнергетического оптического излучения определено достоверное увеличение биосинтеза этих кислот, что свидетельствует об активизации ядерного аппарата, системы ДНК-РНК-белок и биосинтетических процессов в клетках [9]. Низкоэнергетическое оптическое облучение биообъекта вызывает в тканях и органах различные эффекты, связанные как с непосредственным, так и опосредованным действием электромагнитных волн оптического диапазона. При этом такое излучение взаимодействует с фотоакцепторами, запуская весь комплекс фотофизических и фотохимических реакций. Помимо фотоакцепторов на прямое воздействие электромагнитных волн реагирует также и различные молекулярные образования, в которых происходит нарушения слабых атомно-молекулярных связей, что в свою очередь дополняет и усиливает эффект непосредственного влияния облучения. Опосредованное действие связано либо с трансформацией энергии излучения и ее дальнейшей миграцией, либо с передачей этой энергии или эффекта от ее воздействия различными путями и способами. Основными проявлениями этого действия могут быть переизлучение клетками электромагнитных волн, передача эффекта воздействия низкоэнергетического излучения через жидкие среды организма, либо передача энергии этого излучения по каналам рефлексотерапии, т.е. такое излучение способно осуществлять информационно-волновую функцию [2, 4]. Поскольку действующее на биообъект оптическое излучение является энергетическим фактором, то в результате непосредственного и опосредованного влияния происходит, в первую очередь изменение энергетических параметров внутренний среды организма. Это и образование электронных возбужденных состояний биомолекул, и проявление внутреннего фотоэлектрического эффекта, и изменение энергетической активности клеточных мембран, и другие процессы, связанные с миграцией энергии электронного возбуждения [1, 15]. Полученные нами данные на примере основной группы химиотерапии с фотомодификацией, подтверждают данные положения.
Кроме того, известно, что повышение неспецифической противоопухолевой резистентности сопровождается мобилизацией клеточного звена естественной противоопухолевой резистентности организма, проявляющейся в увеличении числа и качества нейтрофилов с более высоким уровнем содержания показателей КБ [14], поэтому мы можем предполагать, что с помощью воздействия СДИ красного спектра можно оказывать влияние на уровень неспецифической противоопухолевой резистентности, с целью ее повышения, что нашло отражение в формировании антистрессорных неспецифических адапационных реакций. Иными словами, основываясь на полученных данных, можно констатировать, что наблюдаемые нами деструктивные изменения в структуре опухолей легких (кариопикноз, кариорексис, лизис ядер и клеток опухоли, инфильтрация соединительной тканью, активация нейтрофильного звена и других лимфоцитарных элементов иммунной системы животного) являются следствием как минимум двух причин. Во-первых, локального повышения противоопухолевой резистентности, связанного с эффекторными механизмами клеточной резистентности; во-вторых, сформированных на уровне всего организма под действием СДИ, общих антистрессорных неспецифических адаптационных реакций.
Таким образом, мы можем прийти к заключению, что воздействие красным светом в этом режиме приводит к увеличению противоопухолевой эффективности циклофосфана, способствуя регрессу опухолей С45 в легких, и повышению неспецифической противоопухолевой резистентности, на что указывают высокие значения молекулярных и клеточных критериев интегральных реакций организма, характеризующих совокупный эффект противоопухолевой терапии в эксперименте.

