Для извлечения ионов меди из сточных вод различных промышленных предприятий широко применяются сорбционные методы [1, 3, 5, 6]. При сорбции из растворов происходит поглощение сорбентом как ионов меди, так и молекул воды. При извлечении из водных растворов ионов металлов, молекулы воды составляют им конкуренцию. В результате сорбции наблюдается конкуренция двух видов межмолекулярных взаимодействий: гидратация ионов металлов и взаимодействие ионов металлов с сорбентом [2].
Гидратная оболочка препятствует сорбции ионов меди вследствие уменьшения электрического взаимодействия. Чем больше у иона величина ионного потенциала, тем сильнее он гидратируется в воде. Катион Сu2+ характеризуется радиусом гидратированного иона равный 4,19.
Для очистки сточных вод от ионов цветных и тяжелых металлов основной практической задачей является подбор местных материалов, их доступность и обладающих достаточной глубиной очистки.
Целью данной работы является исследование ионообменных свойств каолинита по отношению к катионам меди, определение его сорбционных характеристик, а также экспериментальное подтверждение целесообразности применения сорбента для очистки природных и сточных вод промышленных предприятий.
Материалы и методы исследования
Исследована сорбционная способность каолинита по отношению к катионам меди (II) на природном сорбенте – каолините. Для изучения процесса сорбции использовали природный минерал каолинит с размером частиц 2,5÷3,5 мм.
Сорбцию проводили в статических условиях по отношению к ионам меди методом переменных концентраций при температуре от 25 до 60 °С с использованием термостатированного шкафа с точностью ± 1 °С. Сорбент массой 1 г помещали в колбу и заливали 50 мл раствора. Растворы готовили методам разбавления раствора сульфата меди с концентрациями ионов меди от 0,01 М до 0,24 М.
Концентрацию ионов меди определяли по методике [4].
Результаты исследования и их обсуждение
На основании полученных данных рассчитали статическую емкость сорбции ионов меди Г, (ммоль/г) :
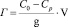 , моль/г
, моль/г
коэффициент распределения Кd, мл/г
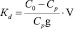 , мл/г
, мл/г
и степень сорбции α ( %)
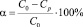 ,
,
где C0 – концентрация элемента в исходном растворе, ммоль/л; Cp – равновесная (остаточная) концентрация извлекаемого иона в растворе, ммоль/л; V – объем раствора, л; g – масса сорбента, г.
Полученные данные по сорбции (табл. 1) ионов меди (II) показывают о высокой сорбционной активности каолинита. Степень извлечения до 0,06 М раствора близка к 100 %. На рис. 1 представлены результаты степени извлечения ионов меди при изменении температуры процесса. Из графической зависимости видно, что с увеличением исходной концентрации степень очистки растворов от ионов меди снижается. Это можно объяснить тем, что с увеличением концентрации исходного раствора ионная сила растворов увеличивается, при этом активность ионов меди уменьшается. Таким образом, свободных ионов меди в растворе становиться меньше и степень сорбции должна уменьшаться.
С практической точки зрения эффективность очистки растворов зависит от соотношения расхода сорбента и объема очищаемого раствора. Известно, что величина сорбции (Г, ммоль/г) определяется соотношением массы сорбента и содержания ионов в очищаемом растворе, то есть, его концентрацией и объемом. На рис. 2 видно, что с увеличением объема раствора сульфата меди с концентрацией 0,02 М при постоянной навески каолинита происходит увеличение величины сорбции.
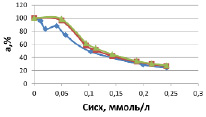
Рис. 1. Изменение степени извлечения ионов меди (II) при сорбции в зависимости от температуры, К: 1. – 298, 2. – 307, 3. – 313
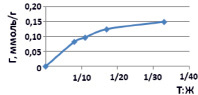
Рис. 2. Зависимость сорбции ионов меди из раствора с концентрацией 0,02 М раствора от соотношения Т/Ж
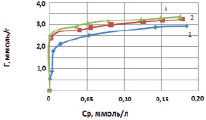
Рис. 3. Изотермы сорбции меди на каолините при температурах, К: 298 (1); 313 (2); 333 (3)
Таблица 1
Коэффициент распределения, степень сорбции и статическая обменная емкость каолинита при извлечении меди (II) из растворов при температуре 298 К
|
C0, ммоль/мл |
0,01 |
0,02 |
0,04 |
0,06 |
0,10 |
0,20 |
0,24 |
|
Cp, ммоль/мл |
0,0005 |
0,0035 |
0,005 |
0,015 |
0,053 |
0,142 |
0,184 |
|
Кd, мл/г |
1100 |
250 |
360 |
141,7 |
47,6 |
20,5 |
16,1 |
|
α, % |
95,65 |
83,33 |
87,80 |
73,91 |
48,79 |
29,07 |
24,33 |
|
Г, ммоль/г |
0,55 |
0,88 |
1,8 |
2,13 |
2,53 |
2,90 |
2,95 |
Значит, при снижении отношения Т:Ж содержание ионов меди в растворе обеспечивает частичное заполнение активных центров поверхности.
Количество поглощенных ионов закономерно увеличивается с ростом их содержания в исходном растворе. Статистическая обменная емкость каолинита, контактирующего с растворами, исходная концентрация которых более 12 г/л составляет 4,6 мг/г (или 2,9 ммоль/г).
По полученным результатам строили изотермы сорбции, дающие основные сведения о сорбционных свойствах материала и характере сорбции на нем определенных веществ. На рис. 3 представлены изотермы сорбции ионов меди на природном каолините при разных температурах. Полученные результаты показывают, что с увеличением концентрации в исходном растворе величина сорбции возрастает. Изотерма имеет резкий подъем в области малых равновесных концентраций, на котором количество сорбированного иона металла практически пропорционально его содержанию в растворе (участок Генри), и характерный участок насыщения сорбента в данных условиях.
Изотермы сорбции ионов меди на каолините описываются изотермой I типа [], что позволило рассчитать адсорбционные параметры с использованием теории мономолекулярной адсорбции по уравнению Ленгмюра, записанного в линейной форме:
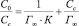 ,
,
где Г∞ – предельная емкость сорбента, ммоль/г; Сс – количество сорбированных ионов меди, ммоль/г; К – константа сорбционного взаимодействия, характеризующая интенсивность сорбции, мл/ммоль.
Результаты расчета приведены в табл. 2.
С увеличением температуры с 298 до 333 К происходит возрастание величины сорбции. Это означает, что при более высокой температуре величина сорбции ионов меди возрастает с 2,97 ммоль/г до 3,46 ммоль/г.
Таблица 2
Параметры сорбции ионов меди на каолините
|
Параметр сорбции |
298 К |
318 К |
333 К |
|
Г∞, ммоль/г |
2,97 |
3,39 |
3,46 |
|
К, мл/ммоль |
0,333 |
0,307 |
0,296 |
Заключение
По результатам работы можно сделать вывод, что природный каолинит обладает высокими сорбционными свойствами по отношению к ионам меди. Сорбция ионов меди достигает максимального значения при определенном соотношении твердое/жидкость для исследуемой концентрации раствора сульфата меди.

