Конечные продукты гликозилирования формируются в процессе комплексных многоступенчатых реакций, инициированных спонтанным неферментативным гликозилированием внутри- и внеклеточных белков, липидов и нуклеиновых кислот [1, 3, 5]. С возрастом количество конечных продуктов гликозилирования в коже возрастает вследствие аккумуляции внеклеточных продуктов гликозилирования на долгоживущих матриксных белках дермы и снижения активности внутренних детоксикационных механизмов, ответственных за элиминацию внутриклеточных AGE в эпидермальных кератиноцитах и дермальных фибробластах [1, 2, 4, 6]. Аккумуляция AGE в коже способствует развитию ключевых патологических процессов старения [2, 4], что предопределяет огромный потенциал для разработки новых активных препаратов против старения, направленных на снижение образования или элиминацию конечных продуктов гликозилирования. Эффективная разработка препаратов, снижающих количество AGE в коже, нуждается в поиске надёжных биомаркёров, при этом собственная флюоресценция AGE в сине-зелёном спектре применяется в ряде исследований как простой, неинвазивный способ измерения общего количества AGE в коже человека [2, 3, 5, 7]. Используя in vivo мультифотонную томографию, мы установили, какой вклад в общую флюоресценцию кожи волонтёра в спектре, испускаемом AGE, привносит каждый её слой, доступный по глубине детекции выбранным методом, сделав акцент на возрастные изменения в автофлюоресценции кожных слоёв.
Материалы и методы исследования
Трёхмерные пакеты имиджей 500 мкм×500 мкм, количеством 10, охватывающие для каждого волонтёра общую площадь кожи 0,25 мм2 и выполненные на глубину 150 мкм с шагом 2 мкм, были получены с помощью двухфотонного микроскопа FluoView 1200 MP (Olympus). Возбуждение осуществлялось инфракрасным лазерным излучением длиной волны 800 нм (Ti:Sapphire Mai-Tai DeepSee femtosecond laser, Spectra Physics) через объектив XL Plan N 25X (Olympus). Для исследования были выбраны участки кожи на внутренней стороне предплечья, наименее подверженные экспозиции прямых солнечных лучей. Исследование было проведено на 8 здоровых волонтёрах обоего пола в возрасте от 24 до 67 лет. Эмиссию детектировали одновременно в четырёх спектральных каналах (рис. 1), два из которых использовали для оценки второй гармоники (397-412 нм) и автофлюоресценции (455-490 нм).
Обработка данных была выполнена с помощью специально разработанного в компании Neurotar программного обеспечения. На основании кривых распределения интенсивности сигналов второй гармоники (коллаген) и автофлюоресценции (кератин, NAD(P)H, меланин, эластин, AGE) по глубине производилось автоматическое разделение доступного для двухфотонной микроскопии сегмента кожи на роговой, зернистый, шиповатый и базальный слои эпидермиса и сосочковый слой дермы (рис. 1, А, Б, В). Суммарная интенсивность автофлюоресценции рассчитывалась для каждого слоя кожи отдельно как интеграл под соответствующим участком кривой (рис. 1, В).
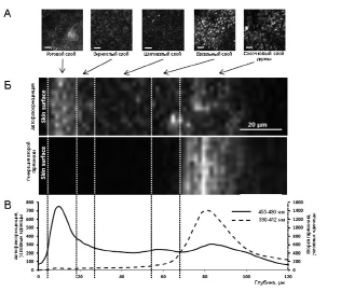
Рис. 1. А, репрезентативные in vivo двухфотонные изображения кожи человека в проекции горизонтальных xy координат, соответствующие различным слоям эпидермиса и дермы. Масштаб 20 мкм. Б, Z-проекция in vivo двухфотонных изображений кожи предплечья 58-летней здоровой женщины: верхняя панель представляет автофлюоресцентный сигнал, нижняя панель – генерацию второй гармоники. В, кривые сигнала второй гармоники (коллаген) по Z-оси (пунктир) и автофлюоресценции (сплошная линия), построенные против соответствующей глубины сканирования кожных слоёв. Вертикальные пунктирные линии отмечают границы анализируемых слоев кожи
Результаты исследования и их обсуждение
В соответствии с литературными данными (5), суммарный автофлюоресцентный сигнал, полученный со всех слоёв кожного сегмента, демонстрировал сильную позитивную корреляцию с возрастом (R = 0,859, p = 0,006) (рис. 2, А).
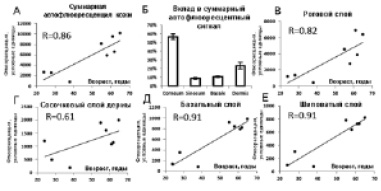
Рис. 2. А, суммарный эмиттированный автофлюоресцентный сигнал в диапазоне 455-490 нм, отнесённый к возрасту волонтёра. Б, процентный клад каждого слоя кожного сегмента в общий испущенный автофлюоресцентный сигнал. В-Е, автофлюоресцентный сигнал в диапазоне 455-490 нм, отнесенный к возрасту волонтера, рассчитанный для рогового, шиповатого, базального слоев эпидермиса и сосочкового слоя дермы, соответственно
Чтобы установить вклад различных компонентов кожи в общую автофлюоресценцию, эмиттированную кожным сегментом, мы воспользовались преимуществами двухфотонной микроскопии, заключающимися в отличном вертикальном разрешении (1-2 мкм), что позволило детектировать автофлюоресценцию каждого слоя кожи отдельно. Как показано на рис. 2, Б, более половины (56,6 ± 3,0 %) общей АФ в сине-зелёном спектре (455-490 нм), испущенной из участка кожи глубиной 150 мкм, приходилось на роговой слой. Другим компонентом, вносящим существенный вклад (23,6 ± 3,6 %) в общую автофлюоресценцию, оказался сосочковый слой дермы, и только одна пятая суммарного АФ сигнала генерировалась метаболически активными слоями эпидермиса (10,7 ± 1.,1 % вносил базальный слой и 9,1 ± 0,9 % – шиповатый). Далее мы обратились к вопросу о наличии корреляции АФ отдельных кожных слоёв с возрастом волонтёров. В ходе анализа было показано, что роговой слой, вносящий наиболее весомый вклад в общую АФ кожных покровов, демонстрирует среднюю корреляцию с возрастом волонтёра (R = 0,823) с достоверностью p = 0,012 (рис. 2, В). Не было обнаружено статистически достоверной корреляции в верхних слоях папиллярного слоя дермы, доступных качественной двухфотонной детекции (R = 0,609, p = 0,109) (рис. 2, Г). Наиболее сильная корреляция с возрастом была показана для АФ сигнала, полученного из метаболически активного эпидермиса. Высокая степень статистической достоверности отмечалась как для шиповатого (R = 0,914, p = 0,001), так и для базального слоёв (R = 0,907, p = 0,002) (рис. 2, Д, Е). Хотя биохимические данные свидетельствуют о том, что с возрастом количество конечных продуктов гликирования увеличивается главным образом в дерме и роговом слое эпидермиса [5, 6], высокая индивидуальная вариабельность эндогенных флюорофоров, таких как эластин и кератин, соответственно, может ставить под сомнение специфичность результатов детекции AGE, основанных на регистрации суммарного автофлюоресцентного сигнала. В этом случае вычитание эмиссии кожных слоёв, содержащих наибольшее количество естественных флюорофоров, может увеличить чистоту и специфичность сигнала, генерируемого конечными продуктами неферментативного гликозилирования. В отличие от дермы и рогового слоя эпидермиса, шиповатый слой характеризуется наименьшим количеством эндогенных флюорофоров, эмиттирующих в сине-зелёном спектре. Основной молекулой метаболически активного эпидермиса, детектируемой в канале 455-490 нм, является NAD(P)H [7].
Заключение
Принимая во внимание, что наименьший флюоресцентный фон, обусловленный присутствием эндогенных флюорофоров и не связанный с аккумуляцией AGE, был зарегистрирован в шиповатом слое эпидермиса, а также наиболее сильные показатели корреляции АФ с возрастом наблюдались именно в этом слое, мы предлагаем метод специфической детекции аккумуляции AGE, основанный на селективном измерении АФ шиповатого слоя. Учитывая интенсивную пролиферацию базальных кератиноцитов и высокую скорость обновления клеток шиповатого слоя эпидермиса, селективное измерение АФ AGE может служить одним из методов неинвазивного скрининга препаратов, направленных на снижение образования или ускоренную элиминацию конечных продуктов гликирования. В настоящее время мультифотонная томография является наилучшим методом для проведения неинвазивного проспективного количественного определения AGE в коже человека.

