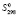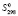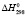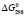Тройные системы PbS–Bi2S3, SnS–Bi2S3 и PbS–SnS, составляющие квазитройную систему, изучены подробно [1, 8-9]. В системе PbS–Bi2S3 обнаружены тройные соединения Pb3Bi2S6, PbBi2S4, PbBi4S7 и PbBi6S10. Из них только PbBi4S7 плавится конгруэнтно при 1070 К, а остальные соединения образуются по перитектической реакции [9]. В системе Bi2S3–SnS обнаружено всего одно соединение SnBi2S4, плавящееся конгруэнтно при 930 К, а в системе Bi2S3–Sb2S3 образуются беспрерывные ряды твердых растворов, относящиеся к структурному типу стибнита.
Целью исследования настоящей работы является – получение монокристаллов методом химической транспортной реакции и определение расчетным путем термодинамических функции соединений квазитройной системы SnS-Bi2S3-PbS.
Материалы и методы исследования
Сплавы для исследования были синтезированы из бинарных сульфидов PbS, Bi2S3 и SnS в эвакуированных кварцевых ампулах при температуре 950-1000 К. Состав четырехкомпонентных образцов рассчитывали из масс сульфидов PbS, SnS и Bi2S3, содержание которых в образцах в процессе их термообработки не изменилось. Условия синтеза выбирали так, чтобы избежать потерь серы вследствие термодиссоциации образцов. Продолжительность обработки литых сплавов, обеспечивающая достижение равновесия в данных условиях, определяли экспериментально, контролируя фазовый состав и микроструктуру образцов. Время отжига при 400 К – 45 ч, при 600 К – 120 ч и при 750 К – 120 ч.
Отожженные сплавы были изучены четырьмя независимыми методами. Дифференциально-термический анализ проводили на установке НТР-70 (в качестве термопары использовали хромель-алюмелевую термопару), рентгенофазовый анализ (РФА) выполняли на рентгендифрактометре ДРОН-2 (CuKα-излучение, Ni-фильтр), микроструктурный анализ (МСА) проводили на микроскопе МИМ-7, а микротвердость образцов измеряли на микротвердомере марки РМТ-3.
В литературе отсутствует сведение для термодинамических функций соединений Pb2SnBi2S6, PbSnBi4S8 и PbSnBi6S11, а также для тройных соединений PbBi2S4, Pb3Bi2S6, PbSnS2, PbBi4S7, и PbBi6S10,образующихся в граничных системах. Это связано с трудностью получения надежных экспериментальных данных для определения термодинамических функций образования многокомпонентных халькогенидов, в частности сульфидов. В этой работе стандартная энтропия 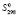 , энтропия D
, энтропия D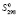 , энтальпия
, энтальпия 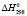 и свободная энергия образования
и свободная энергия образования 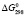 вышеперечисленных соединений определены надежными расчетными методами, которые ранее успешно апробированы на реальных системах [4, 5].
вышеперечисленных соединений определены надежными расчетными методами, которые ранее успешно апробированы на реальных системах [4, 5].
Результаты исследования и их обсуждение
Для структурных и оптических измерений разработаны технологические условия роста совершенные кристаллов четверных соединений. Монокристаллы Pb2SnBi2S6, PbSnBi4S8 и PbSnBi6S11 получали методом химической транспортной реакции. Режим их выращивания приведен в табл. 1.
Таблица 1
Оптимальные технологические режимы получения монокристаллов соединений системы PbS–Bi2S3–SnS
|
Соединение |
Температура зон, К |
|
Время роста, τ, ч |
Размер моно-кристаллов, мм |
|
|
Т1 |
Т2 |
||||
|
Pb2SnBi2S6 |
910 |
800 |
4,0 |
72 |
1,5х2,5х1,0 |
|
PbSnBi4S8 |
825 |
715 |
5,0 |
80 |
2,0х1,5х1,0 |
|
PbSnBi6S11 |
725 |
615 |
4,0 |
80 |
7,5х2,0х1,5 |
Монокристаллы выращивали в двухзонной печи. В качестве переносчика использовали йод, оптимальная концентрация его оказалась 4,5-5,0 мг/см3. Перенос происходил из высокотемпературной зоны (Т2) в зону низкой температуры (Т1). В результате были получены совершенные кристаллы размерами 1,5х2,5х1,0 (мм).
Рентгеноструктурное исследование показало, что полученные сложные сульфиды кристаллизуются в ромбической сингонии (табл. 2).
Таблица 2
Кристаллографические и некоторые физико-химические данные соединений системы PbS–Bi2S3–SnS
|
Соединение |
Параметры решетки, Å |
ν, Å3 |
Температура плавления, К |
Микротвердость, мПа |
||
|
а |
b |
с |
||||
|
Pb2SnBi2S6 |
15,60 |
7,80 |
4,26 |
518,36 |
1000 |
1950 |
|
PbSnBi4S8 |
21,78 |
7,52 |
4,20 |
687,89 |
950 |
1520 |
|
PbSnBi6S11 |
11,18 |
4,12 |
4,54 |
531,55 |
880 |
1650 |
Стандартную энтропию вычислили, двумя независимыми методами. По методу Келли стандартная энтропия соединений равняется сумме инкрементов парциальных энтропий составляющих их ионов. Например:
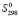 (Pb2SnBi2S6) = 2
(Pb2SnBi2S6) = 2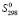 (Pb2+) +
(Pb2+) + 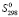 (Sn2+) + 2
(Sn2+) + 2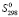 (Bi3+) + 6
(Bi3+) + 6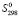 (S2−)
(S2−)
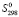 (PbSnBi4S8) =
(PbSnBi4S8) =  (Pb2+) +
(Pb2+) + 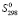 (Sn2+) + 4
(Sn2+) + 4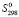 (Bi3+) + 8
(Bi3+) + 8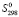 (S2−) (1)
(S2−) (1)
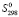 (PbSnBi6S11) =
(PbSnBi6S11) = 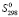 (Pb2+) +
(Pb2+) + 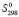 (Sn2+) + 6
(Sn2+) + 6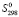 (Bi3+) + 11
(Bi3+) + 11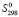 (S2−)
(S2−)
В расчетах использованы следующие значения инкрементов ионов [4]:
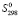 (Pb2+) = 72.1,
(Pb2+) = 72.1, 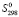 (Sn2+) = 57.1,
(Sn2+) = 57.1, 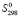 (Bi3+) = 70.23,
(Bi3+) = 70.23,
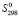 (S2−) = 20.0 Дж/(моль⋅K)
(S2−) = 20.0 Дж/(моль⋅K)
По второму методу стандартная энтропия вычислена по уравнению Истмена:
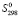 = 0,75 nR
= 0,75 nR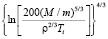 (2)
(2)
Здесь n – количество атомов в молекуле, M – молярная масса, Ti – температура плавления соединения, r – плотность (г/см3).
Таблица 3
Термодинамические функции образования соединений
|
Соединение |
|
−D |
− |
− |
|
Дж/(моль×K) |
Дж/моль |
|||
|
SnS |
77.04 |
0.38 |
110.70 |
110.59 |
|
PbS |
91.30 |
5.46 |
100.12 |
98.49 |
|
Bi2S3 |
200.56 |
9.12 |
155.76 |
153.05 |
|
PbBi2S4 |
292.56 |
14.18 |
303.86 |
299.67 |
|
PbSnS2 |
169.10 |
4.32 |
224.81 |
223.52 |
|
Pb3Bi2S6 |
476.76 |
24.11 |
528.12 |
520.93 |
|
SnBi2S4 |
277.56 |
8.28 |
314.50 |
312.03 |
|
PbBi4S7 |
493.02 |
23.41 |
495.71 |
488.43 |
|
PbBi6S10 |
693.48 |
32.63 |
687.52 |
677.80 |
|
PbSnBi6S11 |
770.58 |
31.68 |
810.21 |
800.77 |
|
Pb2SnBi2S6 |
461.66 |
17.50 |
538.73 |
533.51 |
|
PbSnBi4S8 |
570.12 |
22.56 |
518.42 |
511.70 |
Стандартная энтропия соединений, образующихся в результате перитектической реакции, вычислена по следующему уравнению Истмена:
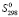 =
= 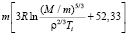 (3)
(3)
Ti – температура протекания перитектической реакции:
Значения стандартной энтропии, рассчитанные по соотношениям (1,2 и 3) не существенно отличаются. Преимущество метода Келли заключается в том, что известны значения инкрементов энтропии составляющих ионов [4-6], а значения для плотности соединений, температуры перитектического превращения не требуются.
Энтропия образования четверных и тройных соединений (?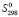 ) равняется разности их стандартных энтропий и энтропии составляющих простых веществ. Например:
) равняется разности их стандартных энтропий и энтропии составляющих простых веществ. Например:
D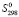 (Pb2SnBi2S6) =
(Pb2SnBi2S6) = 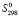 (Pb2SnBi2S6)–[2
(Pb2SnBi2S6)–[2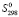 (Pb) +
(Pb) + 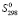 (Sn) + 2
(Sn) + 2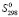 (Bi) + 6
(Bi) + 6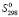 (S)]
(S)]
D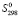 (PbSnBi4S8) =
(PbSnBi4S8) = 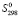 (PbSnBi4S8)–[
(PbSnBi4S8)–[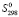 (Pb) +
(Pb) + 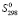 (Sn) + 4
(Sn) + 4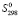 (Bi) + 8
(Bi) + 8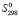 (S)] (4)
(S)] (4)
D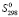 (PbSnBi6S11) =
(PbSnBi6S11) = 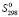 (PbSnBi4S8)–[
(PbSnBi4S8)–[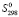 (Pb) +
(Pb) + 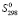 (Sn) + 4
(Sn) + 4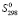 (Bi) + 11
(Bi) + 11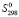 (S)]
(S)]
Значения энтропии образования четверных и тройных соединений (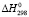 ) вычислены на основе значений энтальпии образования соответствующих бинарных соединений с учетом отклонения от аддитивности.
) вычислены на основе значений энтальпии образования соответствующих бинарных соединений с учетом отклонения от аддитивности.
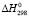 (Pb2SnBi2S6) = 2
(Pb2SnBi2S6) = 2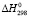 (PbS) +
(PbS) + 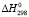 (SnS) +
(SnS) + 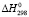 (Bi2S3) + mA
(Bi2S3) + mA
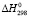 (PbSnBi4S8) =
(PbSnBi4S8) = 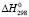 (PbS) +
(PbS) + 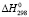 (SnS) + 2
(SnS) + 2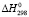 (Bi2S3) + mA (5)
(Bi2S3) + mA (5)
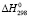 (PbSnBi6S11) =
(PbSnBi6S11) = 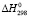 (PbS) +
(PbS) + 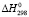 (SnS) + 3
(SnS) + 3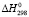 (Bi2S3) + mA
(Bi2S3) + mA
Здесь 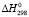 (PbS),
(PbS), 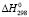 (SnS) и (Bi2S3) – энтальпии образования бинарных соединений [7-10], m – количество атомов в соединении, А – степень отклонения от аддитивности. Для сульфидов взято А = – 12 кДж/(моль×атом) [4, 10]. Свободная энергия соединений была рассчитана по уравнению Гиббса-Гельмгольца:
(SnS) и (Bi2S3) – энтальпии образования бинарных соединений [7-10], m – количество атомов в соединении, А – степень отклонения от аддитивности. Для сульфидов взято А = – 12 кДж/(моль×атом) [4, 10]. Свободная энергия соединений была рассчитана по уравнению Гиббса-Гельмгольца:
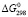 (PbSnBi4S8) =
(PbSnBi4S8) = 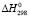 (PbSnBi4S8) – TD
(PbSnBi4S8) – TD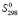 (PbSnBi4S8) (6)
(PbSnBi4S8) (6)
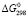 (PbSnBi6S11) =
(PbSnBi6S11) = 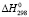 (PbSnBi6S11) –TD
(PbSnBi6S11) –TD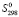 (PbSnBi6S11)
(PbSnBi6S11)
Результаты расчетов вместе с термодинамическими функциями образования двойных соединений приведены в табл. 3.
Полученные значения для термодинамических величин можно считать достаточно надежными и могут быть использованы при прогнозировании химических реакций и выполнении технологических расчетов. Полученная термодинамическая информация была использована при триангуляции квазитройной системы SnS-Bi2S3-PbS .
Температурная зависимость свободной энергии соединений и полученные отрицательные значения для энтальпии образования свидетельствуют об устойчивости соединений в широком диапазоне температур и относительно упорядоченной структуре кристаллов.
Выводы
1. Впервые методом химической транспортной реакции (ХТР) получены монокристаллы соединений системы PbS-Bi2S3-SnS.
2. В результате проведенных рентгенографических исследований выращенных монокристаллов установлено, что Pb2SnBi2S6, PbSnBi4S8 u PbSnBi6S11 кристаллизуются в ромбической сингонии.
3. Впервые расчетным путем определены стандартные энтропии, энтропии, энтальпии и свободные энергии образования соединений системы PbS-Bi2S3-SnS.
4. Температурная зависимость свободной энергии соединений и полученные отрицательные значения для энтальпии образования свидетельствуют об устойчивости соединений в широком диапазоне температур и относительно упорядоченной структуре кристаллов.


 , мг/см3
, мг/см3