Африканская чума свиней – высококонтагиозная вирусная болезнь свиней, склонная к природной очаговости, характеризующаяся высокой летальностью.
С 2007 г. вспышки АЧС регистрируются на территории Европейской части Российской Федерации. Инфекция широко распространяется среди домашних свиней и диких кабанов, нанося огромный экономический ущерб.
Лабораторная диагностика АЧС осуществляется с помощью иммунологических и культуральных методов. В настоящее время для обнаружения АЧС также широко применяется метод ПЦР [1].
Одним из главных достоинств метода ПЦР является его высокая чувствительность. При хорошей пробоподготовке с помощью ПЦР можно определять единичные копии возбудителя инфекций. Однако данное преимущество оборачивается не менее существенной проблемой – появлением ложноположительных результатов. Это может происходить по нескольким причинам, наиболее значимой из которых является контаминация продуктами амплификации.
Основным способом решения описанной проблемы является разделение ПЦР лабораторий на несколько зон. Персонал, осуществляющий обработку биологического материала и постановку ПЦР не должен проводить электрофорез и регистрацию результатов ПЦР-анализа. В лаборатории необходимо регулярно проводить обработку рабочих поверхностей хлорсодержащими препаратами, а после работы использовать УФ излучение с длиной волны 254 или 300 нм [2].
Устранение контаминации на пост-ПЦР этапе сводится к добавлению в пробирки с ампликонами псоралена или изопсоралена, что приводит к образованию ковалентных связей с ДНК. Использование таких молекул в ПЦР в качестве матрицы невозможно.
Однако описанные способы устранения контаминации имеют один серьезный недостаток – они способны полностью уничтожить лишь низкие концентрации ампликонов.
Наиболее надежным вариантом устранения контаминации в ПЦР-лаборатории является использование Урацил-ДНК-гликозилазы (КФ 3.2.2.27), далее УДГ.
Фермент УДГ способен разрушать полученные в ПЦР ампликоны, содержащие урацилы. Таким образом, в случае повторного попадания в ПЦР, такие молекулы не будут амплифицироваться. Причем для того, чтобы предотвратить контаминацию, достаточно удаления хотя бы одного остатка урацила из каждой цепи ДНК ампликона. В то же время ДНК человека и ДНК, выделенная из других живых организмов, не содержит урацилов и, соответственно, не будет служить «мишенью» для УДГ.
В связи с этим целью нашей работы было на примере тест-системы для диагностики АЧС продемонстрировать возможность внедрения УДГ для снижения риска возникновения контаминации в ПЦР-лаборатории.
Материалы и методы исследования
Для тестирования использовалась ранее разработанная в лаборатории тест-система «АЧС», выявляющая вирус африканской чумы свиней (African swine fever virus) в биологическом материале, продуктах свиноводства и изделиях свиного происхождения методом ПЦР (AmpliSens, ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва). Тест-система разработана и выпускается в двух форматах – Eph (с электрофоретической детекцией) и FRT (с гибридизационно-флуоресцентной детекцией в режиме «реального времени»).
Эксперименты проводились на положительных контрольных образцах (ПКО), входящих в состав тест-системы «АЧС». ПКО в данной системе представлял собой инактивированные конструкции генома вируса АЧС.
Для оценки эффективности работы УДГ в ПЦР были наработаны ампликоны АЧС и внутреннего контрольного образца (ВКО). Детекция проводилась двумя способами – электрофоретическим и в режиме реального времени (Real-time). Полученные ампликоны служили матрицей в последующих экспериментах. В приготовленную реакционную смесь добавляли фермент УДГ из расчета 0,2 U на 1 реакцию. После внесения фермента УДГ пробы инкубировали при комнатной температуре 5 минут. Контролем служили реакционные смеси без добавления фермента УДГ.
Амплификацию проводили на приборах RotorGene Q (Qiagen, Германия), ДТ-96 и Терцик (ДНК-технология, РФ).
Результаты исследования и их обсуждение
Ранее в нашей лаборатории в клетках E. coli был получен рекомбинантный фермент УДГ из Североатлантической трески (Gadus morhua). Выбор фермента данного организма был не случаен, поскольку, исходя из литературных данных [3], этот фермент обладает способностью необратимо и полностью инактивироваться при нагревании до 50 °С за 10 минут. Полная и необратимая потеря ферментативной активности при 45–55 °С является необходимым условием для использования УДГ в ПЦР-диагностике поскольку это позволяет избежать «выщепления» остатков урацила из образующихся в процессе амплификации молекул ДНК, и, как следствие, изменения аналитических характеристик набора, что особенно важно для количественных тестов.
Полученный в лаборатории фермент УДГ был охарактеризован по активности с помощью методики, описанной Liu B. et al. [4]. Согласно данной методике, 1 единица активности (U) определялась как количество фермента, который за 1 минуту при 37 °С катализирует высвобождение 60 пмоль урацила из урацилсодержащей ДНК. Такое определение ферментной активности для УДГ является общепризнанным и используется как коммерческими компаниями, производящими ферменты, так и научными лабораториями.
В качестве контроля при определении активности полученного нами рекомбинантного фермента УДГ использовали УДГ зарубежных производителей New England Biolab и Roche Custom Biotech (США).
В ходе проведенных экспериментов был изменен состав реакционной смеси, входящей в тест-систему «АЧС»: вместо дТТФ в смесь включили дУТФ. Было показано, что аналитические характеристики набора при этом не изменились. Это связано с тем, что ДНК-полимераза, используемая в тест-системе «АЧС», содержит мутации, которые позволяют ферменту встраивать дУТФ в растущую цепь ДНК с такой же эффективностью, как и дТТФ.
Известно, что эффективность работы фермента УДГ во многом зависит именно от характеристик ампликона. При использовании АТ-богатой матрицы фермент разрушает ампликоны более эффективно; более длинный ампликон разрушается легче, чем короткий.
Поскольку контаминация (в случае Real-time ПЦР) обычно характеризуется попаданием в пробирку для амплификации порядка 1000–5 000 копий ампликона, для оценки эффективности работы фермента УДГ в ПЦР качестве матрицы добавляли 1 000, 10 000 и 100 000 копий ампликона.
Метод ПЦР с электрофоретической детекцией является более контаминационно опасным, поскольку необходимым этапом здесь является открытие пробирки и извлечение продукта амплификации; поэтому для оценки эффективности работы фермента УДГ в ПЦР с электрофоретической детекцией в качестве матрицы добавляли 10^11 и 10^12 копий ампликонов АЧС и ВКО (рис. 1).
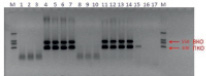
Рис. 1. Электрофореграмма. Разрушение ампликонов при использовании 0,2 U/reac. фермента УДГ (обозначение образцов: 1–3 – ампликоны 10^12 копий с добавлением фермента УДГ, 4–7 – ампликоны 10^12 копий без фермента УДГ, 8–10 – ампликоны 10^11 копий с добавлением фермента УДГ, 11–14 – ампликоны 10^12 копий без фермента УДГ, 15 – положительный контроль амплификации, 16–17 – отрицательные контроли амплификации)
На примере тест-системы «АЧС» было показано, что в случае длинных матриц (300–600 н.п.), характерных для тест-систем с электрофоретической детекцией, фермент УДГ разрушает до 10^12 молекул ампликонов, попавших в реакцию. В случае тест-систем с детекцией в режиме реального времени фермент способен разрушить до 100 000 молекул ампликонов, что позволяет эффективно бороться с контаминацией. Разрушение меньшего числа ампликонов связано с тем, что в данном случае ампликоны (ген АЧС и ВКО) составляют около 80 н.п. Таким образом, фермент УДГ достаточно эффективно работает в ПЦР с различными способами детекции.
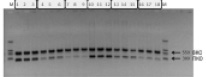
Рис. 2. Электрофореграмма. Оценка влияния 0,2 U/reac. фермента УДГ на чувствительность тест-системы «АЧС» (обозначение образцов:1–3 – 10^5 копий/мл АЧС с добавлением фермента УДГ, 4–6 – 100 000 копий/мл АЧС с добавлением фермента УДГ, 7–9 – 1 000 копий/мл АЧС с добавлением фермента УДГ; 10–12 – 10^5 копий/мл АЧС без фермента УДГ, 13–15 – 10^4 копий/мл АЧС без фермента УДГ, 16–18 – 10^3 копий/мл АЧС без фермента УДГ)
Поскольку для использования в пре-ПЦР формате фермент УДГ не должен оказывать негативного влияния на аналитические характеристики тест-системы путем ингибирования ПЦР, были проведены эксперименты по оценке влияния фермента УДГ на чувствительность тест-системы «АЧС».
Заявленная аналитическая чувствительность тест-системы составляет порядка 2000 копий/мл. Тестирование проводили на инактивированных конструкциях генома вируса АЧС с концентрациями 1 000 коп/мл, 10 000 коп/мл и 100 000 коп/мл.
В результате было показано, что фермент УДГ в концентрации 0,2U на 25 мкл реакционной смеси не оказывает негативного влияния на аналитические характеристики тест-системы, заявленная чувствительность сохраняется как формате Eph (рис. 2), так и в формате FRT.
Для оценки ингибирования ПЦР продуктами распада ампликонов тестирование проводили на инактивированных конструкциях генома вируса АЧС. В ПЦР добавляли 0,2 U фермента УДГ и ампликоны в концентрации порядка 100 000 копий из расчета на 1 реакцию. Контролем служили реакционные смеси без добавления ампликонов.
В результате было показано, что продукты распада ампликонов не оказывают негативного влияния на амплификацию тестируемой мишени, что свидетельствует о том, что аналитические характеристики набора не изменяются.
Заключение
В результате проведенных экспериментов был изменен нуклеотидный состав реакционной смеси, входящей в тест-систему «АЧС», что позволило внедрить фермент УДГ в данную тест-систему. Подобрана оптимальная концентрация УДГ, которая не оказывает негативного влияния на аналитические характеристики тест-системы.
Таким образом, на примере ДНК вируса африканской чумы свиней показано, что фермент УДГ эффективно работает в ПЦР с различными способами детекции вне зависимости от характеристик ампликона, что позволяет эффективно бороться с контаминацией в ПЦР-лаборатории.
Работа поддержана Фондом содействия развитию малых форм предприятий в научно-технической сфере в рамках программы «УМНИК».

