Гипотрофия плода остается одной из ведущих причин перинатальной заболеваемости и смертности новорожденных. В последнее время в развитии ряда заболеваний важное место отводится нарушению барьерной функции клеточных мембран. Изучение мембранной патологии – одно из новых направлений современного акушерства, его возникновение стало возможным благодаря фундаментальным исследованиям структуры и функции биологических мембран [1, 2].
В настоящее время не вызывает сомнения связь между развитием различных патологических процессов в организме и состоянием биологических мембран. По мнению Ю.А. Владимирова ведущей причиной нарушения структуры и функции клеточных мембран является перекисное окисление липидов (ПОЛ) [3]. ПОЛ вызывает окисление тиоловых групп и рост проницаемости мембран для ряда ионов, включая К+, Н+, Са+. Все выше перечисленное приводит к общему снижению резистентности мембраны и в дальнейшем к возникновению патологии [4]. Состояние мембран является одним из центральных факторов поддержания гомеостаза и регуляции биохимических и физиологических процессов в клетках. Ранее опубликованные данные показали, что определение проницаемости эритроцитов может быть успешно применено для оценки состояния мембранного аппарата организма [5].
Несмотря на многочисленные исследования различных аспектов задержки внутриутробного развития плода, многие его стороны остаются малоизученными.
Целью настоящей работы явилось изучение структурно-функциональных свойств мембран эритроцитов беременных женщин с нормальным и низким весом плода.
Материалы и методы исследования
Обследованные женщины были разделены на две группы: первая группа – контрольная – беременные женщины с физиологически протекавшей беременностью со сроком 36-37 недель, без экстрагенитальной и акушерской патологии – 20 женщин; вторая группа – беременные женщины с гипотрофией плода со сроком 36-37 недель – 20 человек.
Для исследования резистентности мембран эритроцитов использовали плазму крови беременных женщин. Для выделения фракции эритроцитов кровь центрифугировали 10 мин при 1000 g. Плазму и лейкоциты удаляли, а эритроциты дважды промывали средой инкубации, содержащей 150 мМ NaCl, 5 мM Na2HPO4 (рН – 7,4).
Проницаемость эритроцитарных мембран (ПЭМ) проводили по ранее описанному методу [5]. Принцип метода определения ПЭМ – гемолиз в смесях изотонических растворов мочевины и хлористого натрия. Использовались рабочие смеси изотонических растворов мочевины (18 г/л) и хлористого натрия (8,5 г/л) в следующих объемных соотношениях: 40:60, 45:55, 50:50,55:45, 60:40 и 65:35. В последней пробирке содержится изотонический раствор мочевины, служащий эталоном 100 % гемолиза, с которым сравнивают все остальные пробы. Через 2-3 мин пробы осторожно перемешивают, центрифугируют 10 мин при 1000g и определяют плотность надосадочной жидкости фотометрированием.
Сахарное сжатие эритроцитов проводили по описанной ранее методике [6]. Клетки крови подвергали гиперосмотическому сжатию в 2 мл 0,2-0,5 М растворах сахарозы при инкубации проб в течение 60 мин при 37 °С. Далее эритроциты центрифугировали 20 мин при 1000 g, затем в супернатанте определяли оптическую плотность при λ = 540 нм.
Полученные результаты статистически обрабатывали с использованием программы «Microsoft Excel», достоверность различий оценивалась по t-критерию Стьюдента.
Результаты исследования и их обсуждение
На рис. 1 представлены данные по определению проницаемости мембран эритроцитов. С увеличением соотношения мочевина/NaCl в среде инкубации наблюдается повышение гемолиза эритроцитов как у контрольных беременных женщин, так и в группе беременных с гипотрофией плода.
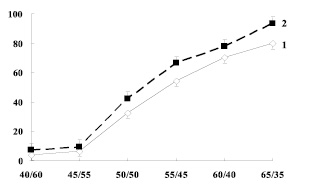
Рис. 1. Изменение проницаемости эритроцитарных мембран у беременных женщин. По оси ординат: величина гемолиза, %; по оси абсцисс: концентрация среды инкубации – мочевина/NaCl, 1 – контрольная группа, 2 – группа с малым весом плода
Так, в среде инкубации, начиная с соотношения в растворе мочевина/NaCl 40/60 до 45/55 отмечается повышение гемолиза и при соотношении в растворе мочевина/NaCl 55/45 достигает у контрольных женщин 54 %, с гипотрофией плода – 66,4 %. Максимальное значение отмечается при соотношении мочевина/NaCl 65/35, так в контрольной группе гемолиз эритроцитов составил 70 %, в группе беременных женщин – 77,8 %.
В следующей серии экспериментов эритроциты беременных женщин подвергали гиперосмотическому сжатию в среде инкубации, содержащей от 0,2 до 0,5 М раствора сахарозы (рис. 2). Инкубация эритроцитов контрольной группы в среде, содержащей 0,3 М раствор сахарозы, вызывает заметное повышение гемолиза мембран до 8,6 %. В опытной группе выход гемоглобина наблюдается уже в 0,2 М растворе сахарозы и достигает 12,1 % (контроль – 5,7 %).
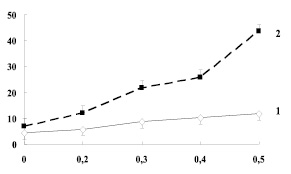
Рис. 2. Гемолиз эритроцитов беременных женщин контрольной и опытной групп при гиперосмотическом сжатии сахарозой. По оси ординат: величина гемолиза %. По оси абсцисс: концентрация сахарозы, М. 1 – контрольная группа, 2 – группа с малым веса плода
С дальнейшим повышением концентрации сахарозы наблюдается увеличение гемолиза эритроцитов как у контрольных беременных женщин, так и у беременных с гипотрофией плода. Так, гемолиз эритроцитов контрольной группы женщин при концентрации сахарозы 0,4 М достигает 10,2 %, при 0,5 % сахарозы – 11,8 %. А у женщин с гипотрофией плода – 25,8 % и 43,5 % соответственно.
Повышение концентрации сахарозы, при которой происходит разрушение эритроцитов мембран у женщин с малым весом плода, говорит о том, что гемолиз эритроцитов происходит не только под действием сахарозного сжатия клетки, но и в результате структурно-функциональных нарушений мембраны эритроцитов [6].
Таким образом, в наших исследованиях выявлено, что одним из факторов задержки развития плода является понижение резистентности эритроцитов, изменение структурных и функциональных свойств мембран, что, несомненно, влияет на адаптационные процессы в организме плода. Полученные результаты свидетельствуют о возможности использования метода определения гемолиза эритроцитов для ранней диагностики задержки развития плода.

