В настоящее время наблюдают увеличение частоты висцеральных микозов у человека. Это, отчасти, связано с широким применением в медицинской практике антибиотиков и иммунодепрессантов [4]. C. аlbicans, среди патогенных грибов, обладает наибольшей вирулентностью и причастны к подавляющему большинству случаев висцеральных микозов, в частности, с тяжелым поражением почек [10].
Помимо прямых деструктивных и гипоксических эффектов, оказываемых грибами на все органы и системы макроорганизма, с их инвазией сопряжены потенциально продеструктивные эффекты нескольких естественных фунгицидных механизмов резистентности макроорганизма. Одним из них является повышенная секреция оксида азота и, в первую очередь, активация «индуцибельной» изоформы NO-синтазы (iNOS) эффекторными клетками [5], которая способна подавлять ферментные системы C. albicans, нарушать гликолиз, а также подавлять метаболизм фосфатов и транспортных систем [8]. Другим вероятным деструктивным эффектом могут быть неокислительные реакции с участием различных лизосомальных ферментов макрофагов в условиях низкого уровня pH в тканях [9], что препятствует жизнедеятельности поглощенных грибов [6]. Этот механизм также потенциально может служить средством подавления С. albicans фагоцитами в составе гранулем.
Однако чрезмерные концентрации NO и лизосомальных ферментов способны инициировать перекисное окисление липидов и могут оказывать цитолитические эффекты на клетки макроорганизма [2].
В связи с вышеизложенным целью исследования было изучение вероятных механизмов патогенеза деструктивных поражений почек при системном кандидозе у мышей линии СBA.
Материалы и методы иcследования
Работа выполнена на 50 мышах-самцах линии СBA двухмесячного возраста с массой тела 20-25 г, полученных из питомника Научно-исследовательского института клинической иммунологии (Новосибирск). Выбор мышей данной линии обусловлен их выраженной иммунной реакцией в ответ на кандидозную инфекцию [7].
Животных держали в стандартных условиях со свободным доступом к воде и пище. Перед проведением эксперимента их адаптировали к условиям содержания. Содержание животных и манипуляции с ними проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения от 12.08.1977 г. № 755), а также с соблюдением международных принципов Хельсинской декларации.
В качестве инфекционного агента использовали высокопатогенный штамм C. albicans РКПГУ-1129/13 (НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург). Для моделирования висцерального кандидоза инфицирование мышей проводили путем внутривенного введения (хвостовая вена) С. albicans в дозе 12,5×106 микробных тел в 0,5 мл 0,85 % водного раствора NaCl. В качестве контроля служили двухмесячные интактные мыши-самцы линии СВА.
Объектом исследования были почки экспериментальных животных, образцы которых получали в 1, 3, 7 и 10 сутки после инфицирования. Животных выводили из эксперимента путем дислокации позвонков в шейном отделе под эфирным наркозом.
Образцы органов фиксировали в нейтральном 10 % водном растворе формалина, обезвоживали в серии спиртов возрастающей концентрации и ксилолах при помощи аппарата для автоматической проводки STP-120 («Microm», Германия), после чего заключали в синтетическую парафиновую среду («НISTOMIX», Россия).
Для светооптического исследования срезы толщиной 4 мкм изготавливали с помощью ротационного микротома («Microm», Германия), окрашивали по стандартной методике гематоксилином и эозином (обзорная) и реактивом Шиффа (ШИК-реакция для визуализации возбудителя).
Для иммуногистохимического (ИГХ) анализа использовали непрямой пероксидазный метод с применением специфических первичных антител: iNOS («Novocastra»), lysozyme («DBS»), myeloperoxidase («DBS»), cathepsin D («DBS»). Для проведения ИГХ-исследования срезы почек подвергали депарафинизации, регидратации, демаскировке антигенов в микроволновой печи мощностью 700W. Время экспозиции с первичными антителами составляло 45 минут при температуре 37 °С. Затем срезы инкубировали с пероксидазным комплексом, DAB–субстратом и дополнительно докрашивали гематоксилином Майера.
Исследование препаратов проводили с помощью микроскопа AxioImager A1 с фотокамерой AxioCam MRc5 (Carl Zeiss, Германия). Морфометрию структурных элементов почек осуществляли с помощью окулярной сетки со 100 точками и тестовой площадью 3,64х105 мкм2 [1] и инструментов программы AxioVision (rel. 4.12). Учитывали объемную плотность и клеточный состав гранулем, объемную плотность скоплений мициллярных форм C. albicans, объемную плотность деструктивных изменений в паренхиме почек, а также численную плотность клеток гранулем и объемную плотность клеток почек, в цитоплазме которых наблюдали положительную реакцию с исследуемыми антителами. Идентифицировали морфологические формы C. albicans. Средние величины исследованных параметров определяли с использованием стандартного пакета программ «Statistica». При условии нормального распределения величин исследуемых параметров применяли t-критерий Стьюдента и проводили корреляционный анализ по Пирсу. Достоверными считали различия между средними величинами исследуемых параметров при р < 0,05.
Результаты исследования и их обсуждение
Через сутки после инфицирования мышей линии СBA С. albicans в легких, печени, почках регистрировали различные морфологические формы грибов, что подтверждает генерализованную форму микотического воспаления [3]. В паренхиме почек регистрировали воспалительные инфильтраты, отек субкапсулярного пространства клубочков почек, полнокровие сосудов и множественные кровоизлияния.
Полиморфизм С. albicans проявлялся формированием мицеллярных форм в лоханке и корковом веществе, а также клетками дрожжевой формы преимущественно в корковом и мозговом слоях почек. Следует отметить, что с 1 по 10 сутки эксперимента, по мере увеличение количества и размеров гранулем, в них наблюдали увеличение различных форм С. albicans – на ранних сроках это были клетки дрожжевой формы (округлые), а на 10 сутках эксперимента преобладали гифы.
Вокруг С. albicans наблюдали инфильтраты, преимущественно из нейтрофилов и макрофагов. Начиная с 1 суток инфекционного процесса, в паренхиме и строме почек мышей визуализировали микотические гранулемы. Величины объемной плотности скоплений C. albicans увеличились с 1 по 10 сутки после инфицирования в 5,9 раз, объемной плотности гранулем с 1 по 10 сутки развития кандидоза увеличились в 18 раз (рис. 1).
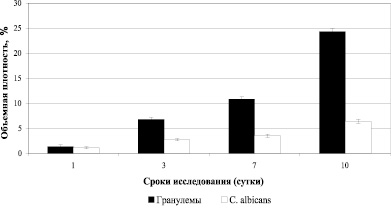
Рис. 1. Результаты исследования объемной плотности гранулем и C. albicans в почках инфицированных мышей
Коэффициент корреляции между ростом объемной плотности скоплений С. albicans (учитывали мицеллярные формы грибов) и объемной плотностью гранулем составил – r = + 0,898.
На ранних сроках после инфицирования в гранулемах преобладали фагоциты – макрофаги и нейтрофилы. Однако количество макрофагов к 10 суткам эксперимента увеличивалось, а количество нейтрофилов – снижалось (табл. 1).
Таблица 1
Результаты исследования клеточного состава гранулем в почках мышей линии СВА, инфицированных высокопатогенным штаммом C. albicans РКПГУ-1129/13 (M ± m)
|
Клеточный состав гранулем ( %) |
Периоды наблюдения (сутки) |
|||
|
1 |
3 |
7 |
10 |
|
|
Эпителиоидные клетки |
3,1 ± 0,36 |
6,5 ± 0,47a |
11,4 ± 1,63a |
13,2 ± 1,76 |
|
Макрофаги |
60,2 ± 1,75 |
62,2 ± 2,85 |
64,5 ± 2,85 |
66,6 ± 1,83 |
|
Нейтрофилы |
27,4 ± 1,69 |
18,3 ± 0,47a |
9,6 ± 1,12a |
5,9 ± 0,52a |
|
Лимфоциты |
7,0 ± 0,77 |
10,4 ± 1,76a |
10,9 ± 1,55 |
8,2 ± 0,81a |
|
Фибробласты |
2,3 ± 0,57 |
2,6 ± 0,47 |
3,5 ± 0,35a |
6,2 ± 0,21a |
Примечание. «а» – достоверность различий параметров по срокам, при р < 0,05. За 100 % принимались все клетки в гранулемах.
Количество эпителиоидных клеток увеличивалось с 1 по 10 сутки эксперимента в 4,2 раза, что положительно коррелирует с увеличением показателей объемной плотности гранулем (r = + 0,991). Изменения количества лимфоцитов и фибробластов характеризовались сходной тенденцией к увеличению (табл. 1).
Следует отметить, что клетки гранулем (макрофаги, нейтрофилы и эпителиоидные клетки) формируют высокий продеструктивный потенциал за счет высокого содержания в них лизосомальных ферментов (рис. 2).
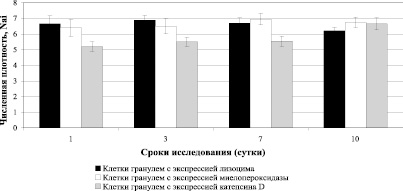
Рис. 2. Результаты исследования численной плотности клеток в гранулемах (макрофагов, нейтрофилов и эпителиоидных клеток), экспрессирующих маркеры лизосомальных ферментов в почках мышей-самцов линии СВА, инфицированных высокопатогенным штаммом C. albicans РКПГУ-1129/13
Экспрессия маркеров лизоцима, миелопероксидазы в клетках гранулем на всех сроках исследования поддерживалась на одном уровне, а экспрессия маркеров катепсина Д, возрастала к 10 суткам эксперимента (рис. 2). Однако эти данные позволяют судить лишь об их возможном вкладе в деструктивные процессы из-за лимитирующего их активность фактора среды pH. О том, что этот потенциал в исследуемый период эксперимента не был в полной мере реализован, свидетельствует отсутствие деструктивных процессов, прежде всего, в гранулемах.
С 1 по 10 сутки после инфицирования, по мере трансформации гранулем в эпителиоидно-макрофагальные, наблюдали снижение экспрессии iNOS макрофагами (табл. 2). Экспрессия же iNOS в эпителиоидных клетках нарастала. Это может быть связано с тем, что эпителиоидные клетки активировались, вследствие слияния с макрофагами, захватившими C. albicans (табл. 2).
Таблица 2
Результаты исследования экспрессии iNOS клетками различного гистогенеза в почках мышей линии СВА, инфицированных высокопатогенным штаммом C. albicans РКПГУ-1129/13 (M ± m)
|
Исследуемый параметр |
Периоды наблюдения (сутки) |
||||
|
1 |
3 |
7 |
10 |
Контроль |
|
|
Численная плотность iNOS + макрофагов гранулем |
6,7 ± 0,42 |
6,1 ± 0,42 |
5,8 ± 0,34b |
5,5 ± 0,47 |
-- |
|
Численная плотность iNOS+ эпителиоидных клеток гранулем |
0,3 ± 0,15 |
0,5 ± 0,13 |
0,5 ± 0,15 |
0,9 ± 0,14b |
-- |
|
Суммарная объемная плотность iNOS+ клеточных структур (вне гранулем) |
5,3 ± 0,67a |
10,1 ± 0,89ab |
15,4 ± 1,04ab |
21,9 ± 1,12ab |
1,4 ± 0,13 |
Примечание. «а» – достоверность различий параметров по сравнению с контролем, «b» – достоверность различий параметров по сравнению с предыдущем сроком исследования, при р < 0,05.
С 1 по 10 сутки после инфицирования наблюдали увеличение в 4,1 раза объемной плотности клеточных структур почки, экспрессирующих iNOS вне гранулем: клеток эпителия проксимальных канальцев и эндотелия капилляров как в интерстиции почек, так и в клубочках (табл. 2).
Увеличение объемной плотности инфекционного агента в почках, а также объемной плотности гранулем с их высоким продеструктивным потенциалом и высокая экспрессия NO клетками различного гистогенеза почки, могут быть рассмотрены в качестве факторов развития ранних деструктивных изменений в почках, в эпителии канальцев, клетках эндотелия и подоцитах клубочков. Деструктивные изменения в виде вакуольной дистрофии и некроза наблюдали вне гранулем, что дает основание рассматривать лизосомы макрофагов гранулем в качестве причинного фактора деструкции структур паренхимы почек возможно в более поздние периоды после инфицирования.
В процессе развития экспериментального кандидоза с 1 по 10 сутки от начала инфицирования, величина показателя объемной плотности дистрофии в почках (вне гранулем) увеличилась в 1,7 раза, а объемная плотность некротически измененных клеток резко увеличилась в 1 сутки эксперимента (12,7 раз) и оставалась высокой до 10 суток после инфицирования (рис. 3).
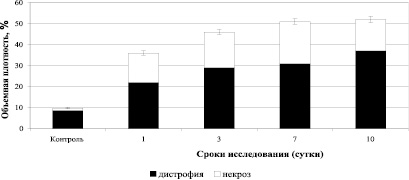
Рис. 3. Результаты исследования объемной плотности деструктивных изменений в почках (вне гранулем) интактных мышей и мышей, инфицированных C. albicans
В почках инфицированных животных вне гранулем, увеличивалась объемная плотность клеточных структур почек, экспрессирующих iNOS и объемная плотность деструктивных изменений в паренхиме почек, коэффициент корреляции между ними был высоким (r = + 0,903). При этом очаги деструкции к 10 суткам после инфицирования топологически располагались, в большей степени, вокруг клеточных структур, экспрессирующих iNOS. Это может служить свидетельством прямого цитотоксического повреждения клеток оксидом азота и, вторично, продуктами перекисного окисления липидов, образующихся под воздействием активированных форм NO и, возможно, лизосомальных гидролаз.
Регистрировали сильную положительную корреляционную связь между клетками гранулем, экспрессирующими маркер миелопероксидазы и катепсина Д и деструктивными изменениями почек вне гранулем соответственно (r = + 0,844 и r = + 0,711). Также, отмечали положительную корреляционную связь между нарастающим количеством клеток, экспрессирующих iNOS; клетками гранулем, экспрессирующими маркеры миелопероксидазы и катепсина Д с объемной плотностью мицеллярных форм C. albicans (соответственно r = + 0,987, r = + 0,612 и r = + 0,973). Это свидетельствует, что на данном этапе развития кандидоза, велики риски развития деструктивных процессов в паренхиме почек в более отдаленные периоды гранулематоза, вследствие деструкции их NO и лизосомальными ферментами, а также токсинами С. albicans, и их прямой деструктивной активности, поскольку в зоне воспаления формируется кислая среда pH.
Лизоцим, по-видимому, не обладает продеструктивным потенциалом (r = – 0,372) и, видимо, направлен, в первую очередь, на уничтожение C. albicans на всех этапах эксперимента (r = – 0,768).
На вероятность непосредственного участия C. albicans (мицеллярные формы) в деструктивных изменениях почек так же указывает высокая степень корреляции их количества и масштабов деструкции в почках, видимо, и за счет механического, а также токсического повреждения – r = + 0,852.
Таким образом, на основании полученных результатов можно предположить, что при моделировании острой фазы гранулематоза, индуцированного C. albicans, ключевыми продеструктивными факторами являются:
- высокая продукция iNOS и, следовательно, NO,
- цитотоксические и, возможно, механические повреждения, реализуемые, в первую очередь, мицеллярными формами инфекционного агента,
- лизосомальные ферменты, обладающие потенциальным продеструктивным потенциалом, экспрессирующиеся клетками гранулем.

