Высокая токсичность синильной кислоты определяет необходимость обеспечения безопасности её производства путем непрерывного контроля и своевременного обнаружения утечек. Эта задача может быть решена только благодаря использованию надежных непрерывно действующих автоматических средств контроля. Наиболее перспективными в настоящее время являются твердотельные датчики с низким энергопотреблением и высокими динамическими характеристиками, выполненные по микроэлектронной технологии.
Цель исследования
Целью теоретических исследований является выявление основных параметров, влияющих на чувствительность микроэлектронного каталитического сенсора, и определение их оптимальных значений для детектирования синильной кислоты. Эта задача может быть решена путем анализа физико-химических процессов, происходящих в структуре микроэлектронного каталитического сенсора в процессе газового анализа, составления математической модели процесса детектирования и ее решения при поставленных начальных и граничных условиях.
Повышение чувствительности и селективности выбранного за основу каталитического сенсора возможно за счет подбора оптимальной рабочей температуры, состава каталитического чувствительного слоя, который обеспечивает избирательность сенсора, а также оптимизации его конструктивных параметров. Поэтому необходимо изучение особенностей гетерогенного катализа при изменении различных условий протекания окислительных реакций.
Результаты исследования и их обсуждение
В результате теоретических исследований были изучены физико-химические процессы, происходящие в структуре каталитического сенсора при детектировании синильной кислоты.
Микроэлектронный каталитический сенсор, схематичный вид которого показан на рис.1, представляет собой пластину кремния с размерами 2.5*2.1 мм и толщиной 250 мкм с нанесенным на нее диэлектриком Si02, толщиной 1.6 мкм. На поверхность слоя диэлектрика нанесен тонкий слой титана для лучшей адгезии к поверхности диэлектрика, а затем тонкий слой платины (Pt), выполняющей одновременно роль чувствительного слоя, нагревательного элемента для поддержания необходимой температуры катализатора и термопреобразователя сопротивления для измерения повышения температуры в процессе каталитической газообразной реакции. Наличие диэлектрической мембраны обеспечивает теплоизоляцию чувствительного слоя от кремниевой подложки. Использование переходных металлов (Pt, Pd,...) в качестве газочувствительного слоя определяется их высокой каталитической активностью по отношению к большому ряду химических реакций, в том числе к реакции окисления. Вместе с тем, они весьма устойчиво ведут себя в условиях повышенных температур и агрессивных сред.
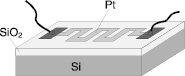
Рис. 1. Схематический вид микроэлектронного каталитического сенсора
Каталитический сенсор позволяет измерять концентрацию газа как функцию повышения температуры, вызванного экзотермической реакцией окисления детектируемого газа на каталитической поверхности. Поэтому необходимо рассмотрение наиболее важных аспектов гетерогенного катализа для определения факторов, влияющих на эксплуатационные характеристики термокаталитических сенсоров.
Акт катализа сопряжен с взаимодействием катализатора с молекулами газа. Его необходимой фазой является «посадка» молекул на поверхность катализатора, т.е. адсорбция. В отличии от физической адсорбции, обусловленной слабыми силами Ван-дер-Ваальса в каталитическом процессе адсорбция должна сопровождаться более или менее сильным взаимодействием адсорбата с катализатором по типу ковалентной или координационной связи. Такой тип адсорбции называется хемосорбцией [1].
Физическая адсорбция протекает с большой скоростью без энергии активации и приводит к равновесному покрытию поверхности катализатора. С повышением температуры равновесное покрытие уменьшается, и, начиная с определенной температуры, может непосредственно осуществляться хемосорбция. Хемосорбция реагирующего вещества осуществляется через активированный комплекс, энергия которого превышает энергию реагирующего вещества, т.е. в большинстве случаев характеризуется определенной энергией активации. Величина энергии активации ЕA определяет скорость хемосорбции.
При хемосорбции происходит смещение электронной плотности, приводящей к разрыву некоторых связей в молекуле реагирующего вещества и образованию новых связей с поверхностными атомами твердого катализатора. Наиболее распространенным видом связи в химических соединениях является двухэлектронная связь. Разрыв двухэлектронной связи может приводить к разрушению электронной пары с образованием неспаренных электронов у каждого из разделяемых атомов (гомолиз) или переходу электронной пары без разрушения к одному из атомов (гетеролиз).
Химические реакции, при которых образование и разрыв двух электронных связей протекает без разрушения и образования электронных пар, называются гетеролитическими [1].
Катализаторы группы гетерогенных реакций должны обладать способностью к образованию координационной связи путем отдачи или присоединения электронной пары. Таким образом, введение катализатора не может увеличить энергии при протекании реакции, но в результате взаимодействия с катализатором появляются частицы, способные аккумулировать энергию активации и использовать ее для продолжения реакции [2].
При измерении концентрации газов в воздухе основным активным компонентом является кислород, поэтому важно исследование взаимодействия каталитических пленок с кислородом. Наличие сенсибилизирующего поверхность пленки кислорода – обязательное условие протекания окислительной реакции детектируемого газа на поверхности датчика [3].
Диссоциативная хемосорбция кислорода на чистых поверхностях металлов протекает с относительно большой скоростью. Энгергия разрыва связей между атомами кислорода достаточно высока и составляет ~ 500 кДж/моль [2]. Диссоциация молекулы кислорода на атомы сопровождается присоединением к кислороду электрона с поверхностных атомов платины и последовательным образованием на поверхности катализатора следующих форм кислорода, представленных на рис. 2.
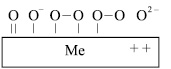
Рис. 2. Диссоциативная хемосорбция кислорода
Взаимодействие заряженных форм кислорода с окисляемым веществом и образование продуктов окисления сопровождается обратным переходом электрона к катализатору. Наличие электронных переходов при промежуточном взаимодействии объясняет исключительную роль соединений переходных металлов как катализаторов реакций окисления. Высокая каталитическая активность соединений d-переходных металлов обусловлена сравнительно небольшой энергией валентных изменений их ионов, что облегчает электронные переходы при взаимодействии с реактантами.
Хемосорбция кислорода на поверхности Pt происходит в два этапа: физическая сорбция
SA( ) + A(газ) → SA(A) + DH1
и хемосорбция (захват электрона)
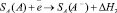 SA(A) +
SA(A) +
+ e¯ → SA(А-) + DH2,
где DH1 – экзотермическая энергия образования физически сорбированной (нейтральной) частицы; DH2 – экзотермическая энергия образования хемосорбированных ионов А-. Необходимое условие:
|DH1| ≥ kT0, (1)
где Т0 – рабочая температура датчика.
При помещении датчика в атмосферу газа, содержащего пары синильной кислоты, происходит взаимодействие молекул синильной кислоты с адсорбированным кислородом. Этот процесс можно считать необходимым условием функционирования каталитического сенсора.
При взаимодействии активного газа (R) с кислородом на первом этапе происходит реакция физической сорбции:
SR( ) + R(газ) → SR(R) + DH3
где SR() – вакантный уровень, DH3 – экзотермическая энергия физической сорбции. Необходимым условием является:
|DH3| ≥ kT0. (2)
Потом следует взаимодействие физически сорбированной частицы с SA(А-):
SA(А-) + SR(R) → SA(B-) + SR( ) + DH4
где DH4 – экзотермическая реакция, В- – хемосорбированные продукты реакции между А- и R.
Дальше происходит эмиссия электрона в зону катализатора:
SA(B-) + DH5 → SA(B) + e¯ ,
Необходимым условием является:
|DH5| < |DH2|
Последним этапом является термическая десорбция продукта реакции В:
SA(B) + DH6 → SA( ) + B(газ)
для чего необходимо, чтобы
|DH6| ≤ kT0, (3)
иначе реакционные состояния будут «отравлены» физически сорбированными продуктами реакции.
Таким образом, суммарная реакция детектирования
R(газ) + SA(A) + DH5 + DH6 →
→ e¯ + SA( ) + B(газ) + DH3 + DH4
показывает, что в результате взаимодействия кислорода с активным газом на поверхности катализатора выделяется тепло
dQ @ – DH = – DH3 – DH4 + DH5 + DH6.
Выделяющееся тепло является количественной мерой реагента R, если известны необходимые термодинамические параметры. Именно измерение количества тепла, образующегося в результате реакции, и представляет интерес.
Механизм окисления синильной кислоты на платиновом катализаторе включает следующие элементарные стадии:
1) O2 + 2[ ] → 2[O];
2) HCN + [ ] → [HCN];
3) HCN + [O] → HCNO + [ ];
4) [HCN] + [O] → HCNO + 2[ ].
Здесь [ ] – свободный для хемосорбции участок на активной поверхности катализатора, HCNO – циановая кислота. Из них может складываться два реакционных маршрута (рис. 3). Первый – ударный механизм Ридила-Или состоит из стадий 1), 3). Второй – адсорбционный механизм Лэнгмюра-Хиншелвуда, включающий стадии стадии 1), 2), и 4). Вопрос определения реакционного механизма имеет принципиальное значение для объяснения и предвидения каталитического действия.
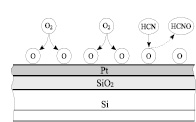
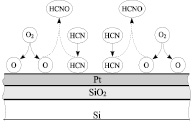
а) б)
Рис. 3. Механизмы взаимодействия HCN с O2:а) механизм Ридила-Или; б) механизм Лэнгмюра-Хиншелвуда
Протекание реакции по ударному механизму Ридила-Или означает, что хемосорбированный кислород настолько реакционноспособен, что синильная кислота может вступать с ним во взаимодействие без активации ее катализатором, то есть без предварительной хемосорбции [4]. В этом случае роль катализатора определяется только его воздействием на кислород, энергией связи и реакционной способностью атомов кислорода на его поверхности. Протекание реакции по адсорбционному механизму Лэнгмюра-Хиншелвуда [5] означает, что наряду с активацией кислорода требуется и воздействие катализатора на синильную кислоту. В этом случае возможно химическое взаимодействие HCN с катализатором, способствующее образованию активированного комплекса, включающего одновременно катализатор и хемосорбированные на нем О и HCN.
При повышении рабочей температуры возможно протекание реакции по адсорбционному механизму с предварительной диссоциацией молекулы HCN на H и CN (H-C обладает меньшей энергией связи (98,75 ккал/моль), чем C≡N (187,3 ккал/моль)) и образованием в качестве продуктов реакции дициана и воды. Тогда основными стадиями процесса будут следующие:
О2 + 2[ ] → 2[O];
HCN + 2[ ] → [H] + [CN];
[CN] + [CN] → (CN)2 + 2[ ];
[O] + 2[H] → H2O + 3[ ];
Возможность протекания реакции по одному из этих маршрутов определяется условиями проведения газового анализа и соотношением концентраций реагирующих веществ. В случае, если СO2 >> CHCN, предполагается , что реакция протекает по ударному механизму Ридила-Или, если же СО2 >> СHCN, то – по адсорбционному механизму Лэнгмюра-Хиншелвуда. При достаточно высокой рабочей температуре и высокой концентрации синильной кислоты хемосорбция HCN блокирует поверхность сенсора и быстрая реакция становится возможной только после освобождения части поверхности для диссоциативной адсорбции кислорода. Наибольшей величины скорость реакции достигает в области полного покрытия поверхности атомами кислорода.
Для составления математической модели детектирования синильной кислоты будем считать, что протекание реакции каталитического окисления на поверхности сенсора идет по ударному механизму, т.к. предельно-допустимая концентрация синильной кислоты в воздухе очень мала. Для упрощения дальнейших выкладок при составлении математической модели к предложенному выше допущению прибавим следующие:
– адсорбция молекул кислорода осуществляется одним слоем (монослоем);
– концентрация кислорода достаточно велика и остается постоянной;
– продукты реакции не хемосорбируются, а сразу десорбируются в газовую фазу;
– все стадии процесса происходят в стационарных условиях, которые определяются равенством скоростей адсорбции, десорбции и реакции взаимодействия.
Выводы
Изложенная выше модель хемосорбции позволяет объяснить селективность каталитических сенсоров к детектируемому газу в относительно узком температурном интервале. Анализ уравнений (1), (2) показывает, что при слишком малой температуре Т0 продукты реакции не будут десорбироваться, препятствуя таким образом дальнейшей адсорбции А (в данном случае кислорода). Если же, наоборот, Т0 слишком велика, кислород не будет сорбироваться, и реакционный газ не станет физически адсорбироваться. Энергия DH4 должна быть немного больше необходимой для передачи электрона от хемосорбированного атома кислорода О в зону катализатора.
Селективность можно определить в двух случаях: компоненты окружающего газа не реагируют с хемосорбированным кислородом или такая реакция происходит, но энергия ее недостаточна для передачи электрона от продукта реакции в зону катализатора. Другой источник селективности можно плучить, анализируя энергию десорбции DН6 физически сорбированного продукта (3): при DН6 << kT0 реакционные состояния насыщены нейтральными продуктами реакции, что препятствует диссоциативной адсорбции кислорода. Таким образом, задача определения оптимальной температуры протекания каталитической реакции окисления молекул синильной кислоты на поверхности сенсора является наиболее актуальной и решается путем изучения механизмов взаимодействия синильной кислоты с кислородом и составления математической модели процесса.

