Кислоторастворимый белок мозга BASP1 (brain acid-soluble protein, синонимы: CAP-23, NAP-22, 2610024P12Rik, Ckap3) известен как универсальный регуляторный мажорный белок позвоночных. В развивающемся мозге количество BASP1 составляет 0,4–0,8 % от общего белка [4]. BASP1 «лежит на пересечении» Са-зависимых путей внутриклеточной передачи сигнала. Известно, что этот белок является мажорным субстратом протеинкиназы С и, в то же время, связывает кальмодулин [4]. BASP1 обнаружен практически во всех тканях организма [3] и локализован в самых разных клеточных структурах в том числе в синапсах [4, 5, 6, 9, 10] и в клеточном ядре [3]. Показано участие, а зачастую и ключевая роль этого белка, в широком спектре процессов, протекающих в клетках организма и, в частности, в нейронах. Установлено, что, BASP1 вовлекается в процессе навигации конусов роста аксонов и ветвлении нервных окончаний [5], транспорте холестерина в нервные окончания [7], выбросе содержимого синаптических пузырьков [9], в процессах транскрипции [3] и, возможно, в формировании ионных каналов [6].
Рассматривается участие BASP1 в патогенезе широкого спектра заболеваний. Так, предполагается его роль как транскрипционного косупрессора WT1 – белка-супрессора опухоли Вильмса (нефробластомы) [3]. В мозге BASP1 может играть роль в дисфункции синапсов, которая характерна для шизофрении [2], а также в патогенезе синдрома Мебиуса (врождённый паралич лицевого и отводящего нервов) [7].
В настоящей работе мы исследовали возможное участие многофункционального регуляторного белка BASP1 в патогенезе геморрагического инсульта при моделировании in vitro.
Опыты проведены на переживающих срезах обонятельной коры мозга гипертензивных крыс-самцов линии SHR массой 250–280 г с соблюдением рекомендаций по этике работы с животными, предложенными European Communities Council Direction (86/609 EEC). Из обонятельной коры обоих полушарий мозга изготавливали по одному тангенциальному срезу толщиной 400–500 мкм весом 32 ± 3 мг специально разработанными инструментами. Из них один использовался как опытный, а другой – как контрольный.
Срезы контрольной группы (n = 40) помещали в стеклянные виалы с искусственной церебральной жидкостью (мM): NaCl – 124,0; KCl – 5,0; CaCl2 – 2,6; KH2PO4 – 1,24; MgSO4 – 1,2; NaHCO3 – 3,0; глюкоза – 10,0; трис-НCl – 23,0. Инкубационный раствор продували кислородом, температуру поддерживали на уровне 37 °С, рН – 7.2 – 7.3, атмосфера над срезами насыщалась кислородом.
Срезы опытной группы (n = 40) помещали в стеклянные виалы с аутокровью объемом 3 мл, которая воздействовала на нервную ткань срезов, моделируя возникновение и развитие геморрагического инсульта [1]. Срезы инкубировались в аутокрови в течение 360 мин. Указанное время соответствует «терапевтическому окну», после которого наступают необратимые нарушения функционирования нервных клеток [1].
В срезах обеих групп регистрировали электрические ответы в пириформной коре на электромикростимуляцию латерального обонятельного тракта. В контрольных срезах сохранялся нормальный электрогенез в течение 6 ч, тогда как в срезах, подвергнутых действию аутокрови, электрические ответы снижались и затем необратимо блокировались.
По окончании нейрофизиологического эксперимента срезы мозга обеих групп хранили в ацетоне (1,5 мл) при температуре – 20 °С. BASP1 дезагрегировали солью [10] и экстрагировали трихлоруксусной кислотой (ТХУ). Для этого срезы извлекали из ацетона, обсушивали на фильтровальной бумаге и гомогенизировали при 0 °С в 10-ти объёмах раствора, содержащего 1 % тритона Х-100, 10 мМ трилона Б и 1 М NaCl. Затем в раствор добавляли ТХУ до конечной концентрации 1 % и экстрагировали ещё в течение 10 мин. Полученный белковый экстракт отделяли от осадка центрифугированием (5000 g, 5 мин) и осаждали добавлением ТХУ до конечной концентрации 10 %. Полученный осадок дважды промывали ацетоном, всякий раз с центрифугированием, высушивали и растворяли в 7,5 М мочевине, подкрашенной метиловым красным (100 мкл).
Изоэлектрическое фокусирование осуществляли при 600 В в течение 20 ч в пластинах 7 %-ного полиакриламидного геля, содержащего 2,5 М мочевину, 2 % амфолитов pI 3,5–5 и 1 % амфолитов pI 3–10 (Fluka, Германия). В качестве электродных буферов использовали 0,02 М NaOH и 0,02 М ортофосфорную кислоту.
Для формирования равномерного градиента рН в зоне нанесения образцов, перед формированием геля из раствора мономеров (с добавлением катализаторов полимеризации) отбирали аликвоту (1,5 мл), которую сохраняли при температуре 0 °С до использования. По окончании формирования геля в карманы наносили исследуемые образцы, затем карманы заполняли доверху раствором мономеров из запасенной аликвоты. Содержимое карманов перемешивали дозатором и полимеризовали под слоем водонасыщенного н-бутанола.
После фокусирования гель выдерживали 10 мин. в дистиллированной воде, затем в течение 10 мин в 1 % уксусной кислоте. Далее осуществляли полусухой электроперенос белков из геля на нитроцеллюлозную или поливинилидендифторидную мембрану в 1 % уксусной кислоте при 10–20 В/см в течение 1 ч.
Избыточную сорбционную ёмкость мембраны исчерпывали вымачиванием в молоке (1 ч). Затем проводили иммунохимическую процедуру. Для этого мембрану с сорбированными белками выдерживали в растворе поликлональных кроличьих антител, полученных нами против BASP1 крысы (1:1000, 10 ч, + 5 °С), промывали физиологическим трис-буферным раствором (ФБР; 3х10 мин). После этих процедур мембрану помещали в раствор мышиных антител против иммуноглобулина G кролика, меченых пероксидазой хрена (Santa Cruz, 1:1000; 1 ч, 37 °С) и снова промывали ФБР (3х10 мин). Пероксидазную активность на мембране выявляли способом усиленной хемилюминесценции (УХЛ).
На рисунке представлены спектры изоформ BASP1, разделённых в соответствии с их изоэлектрической точкой. Ранее было установлено, что BASP1 образует агрегаты, содержащих до десятка и более «мономерных» молекул [10]. Такие агрегированные структуры медленно мигрируют в 7 % геле и, в приведённом на рисунке примере, они локализованы на входе в гель (на дне гелевых карманов против метки «Старт».
Картина распределения изоформ BASP1 довольно диффузна. Это объясняется разнообразием модификаций этого белка: он фосфорилируется протеинкиназой С, казеиновой киназой II, возможно, тирозинкиназами; миристоилируется, связывается с кальмодулином, возможно, АДФ-рибозилируется [5] и, наконец, агрегирует-дезагрегирует [10], причём последний процесс может протекать и непосредственно в геле в процессе изоэлектрического фокусирования, «смазывая» электрофореграмму.
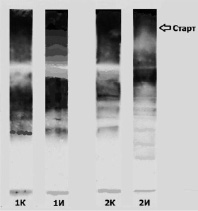
Распределение изоформ BASP1, в экстрактах срезов обонятельной коры мозга крыс линии SHR в контроле (1 К, 2 К) и после воздействия аутокрови в течение 360 мин (1И, 2И, соответственно). Иммунная реплика геля после одномерного изоэлектрического фокусирования. «Старт» – дно гелевого кармана, в который наносился образец. Контрольные и подвергнутые воздействию аутокрови срезы, обозначенные одной цифрой (1 или 2), получены из одного и того же мозга
Результаты проведенных исследований демонстрируют, что спектр изоформ BASP1 даже для контрольных (не подвергнутых воздействию аутокрови) срезов мозга не является стабильным. Однако, во всех исследованных срезах (n = 10) спектр BASP 1 в срезах после длительного действия аутокрови (1И, 2И) отличается от контрольных, взятых из того же мозга (1К, 2К) (рисунок).
При этом после геморрагического инсульта закономерно снижается степень агрегации BASP1 во всех исследованных срезах (n = 10). На рисунке это заметно по уменьшению количества материала против метки «Старт» в модели инсульта (1И, 2И) по сравнению с контрольными срезами (1К, 2К, соответственно).
Агрегация BASP1 является нормальным физиологическим процессом. Полагают, что тороидальные олигомеры этого белка могут формировать ионные каналы в мембранных бислоях [6]. Можно полагать, что уменьшение содержания олигомеров BASP1 после длительного воздействия аутокрови является одной из причин снижения и последующего блокирования электрической активности нейронов и синапсов при развитии геморрагического инсульта.
Более детальное исследование с применением двумерного электрофореза и масс-спектрометрии позволит выявить и другие закономерные изменения гетерогенности BASP1, а также определить, какова именно природа модификаций, приводящих к конкретным изменениям. Всё это может пролить свет на каскад молекулярных процессов, составляющих молекулярных изменений после геморрагического инсульта и выявить эффективные способы лечения этой серьезной нейропатологии.

