На эффективность и качественные характеристики лекарственной формы влияют не только природа вспомогательных веществ, но и их количество и соотношения между собой [1, 4, 7]. Они оказывают существенное влияние на процесс высвобождения лекарственных средств, в связи с чем, проведение биофармацевтических исследований является актуальным при разработке технологии новых лекарственных форм. Целью настоящего исследования было изучение возможности использования спектральных и хроматографических методов для контроля процесса высвобождения и количественное определение кислоты янтарной и никотиновой из суппозиториев [3].
Материалы и методы исследования
На основании проведенных исследований установлено, что оптимальными биофармацевтическими свойствами обладают композиции состава: кислоты никотиновой – 0,5; ПЭГ 4000 – 1,0 кремофор RH – 40 – 12,5; лутрол F- 68 – 7,5; эмульгатор Т- 2 – 0,1 и ПЭГ 400 – 0,5; ПЭГ 1500 – 0,5; ПЭГ 4000 – 0,5; кремофор RH 1,0; твин 80 – 0,1; вода очищенная 0,5 мл; кислота янтарная 0,1 [6].
Предварительные исследования показали, что спектры поглощения кислоты янтарной, ввиду отсутствия хромофорных групп не отличаются четко выраженным максимумом светопоглощения, что не всегда подходит для экспресс – анализа лекарственных средств, особенно при изучении процесса высвобождения в биофармацевтических исследованиях. Изучение спектральных характеристик кислоты никотиновой показало, что характер спектра меняется в зависимости от величины рН. Так, спектр поглощения препарата в кислой среде характеризуется неустойчивым максимумом светопоглощения при 260 – 270 нм, в зависимости от концентрации кислоты никотиновой, а растворы препарата в 0,1 моль/л растворе натрия гидроксида – имеют три максимума светопоглощения в области 260 – 270 нм. При этом характер спектра может меняться в зависимости от концентрации лекарственного средства. Поэтому необходимо было разработать оптимальные методики спектрофотометрического определения исследуемых кислот в лекарственных формах.
В аналитической практике для спектрофотометрического определения веществ часто применяют внешние образцы сравнения, в качестве которых используются соединения органической и неорганической природы, отвечающие требованиям, предъявляемым к образцам сравнения. При выборе внешнего стандарта следует учитывать тот факт, что оптимальным является тот образец, для которого расстояние между положением его максимума и аналитической длиной волны определяемого вещества не превышает половины полуширины полосы поглощения внешнего стандарта [5]. В качестве образца нами был выбран калия дихромат. Известно, что его спектр поглощения при рН 1,1 – 3,0 характеризуется двумя максимумами при 257 ± 2 и 350 ± 2 нм. Аналитическими областями поглощения и величины полуширины (∆), соответственно, составляют 247 – 267 (∆ – 20 нм) и 340,5 – 359,5 (∆ – 20 нм). Известно, что рКа кислоты никотиновой равен 4,73, поэтому оптимальная область рН раствора никотиновой кислоты находится в 7,73. При этом известно, что наиболее стабильна форма кислоты никотиновой в виде аммонийной соли. Однако, высвобождение кислоты никотиновой в ходе диализа более целесообразно проводить в фосфатный буферный раствор со слабощелочным значением рН. Поэтому мы использовали в качестве растворителя фосфатный буферный раствор с рН 7,8. В данном растворителе спектр поглощения калия дихромата характеризуется максимумами при 335 и 375 ± 2 нм.
Результаты исследования и их обсуждение
Исследование характера взаимодействия раствора препарата и извлечения из суппозиторной массы, содержащей кислоту никотиновую, в присутствии с раствором калия дихромата показал, что спектра поглощения обоих растворов характеризуется двумя максимумами светопоглощения при 270 ± 2 и 300 ± 2 нм. Кислота янтарная собой двухосновную карбоновую кислоту, у которой ориентация карбокси – групп может приводить к образованию различных структур и сдвигу полосы поглощения. Установлено, что спектр поглощения раствора кислоты в присутствии калия дихромата характеризуется максимумами светопоглощения при 285 ± 2, 340 ± 2 и 375 ± 2 нм. При этом максимумы в области 340 и 375 нм соответствовали светопоглощению калия дихромата. Для определения линейности методики готовили растворы РСО кислоты никотиновой, янтарной и фумаровой в концентрации 0,002 – 0,02 %. Результаты приведены на рис. 4.
Установлено, что в данном диапазоне и кислота янтарная, и никотиновая имеют линейное светопоглощение. Коэффициент корреляции приближается к 1,0. Оптимальная величина оптической плотности наблюдается в интервале концентраций 0,008 – 0,014 %. Для валидации методики готовили модельные смеси [2]. Результаты количественного определения кислоты никотиновой и янтарной представлены в табл. 1.
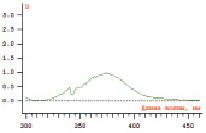
Рис. 1. УФ – спектр раствора калия дихромата в фосфатном буферном растворе
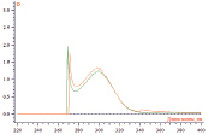
Рис. 2. УФ – спектр поглощения кислоты никотиновой и извлечения из суппозиторной массы с раствором калия дихромата
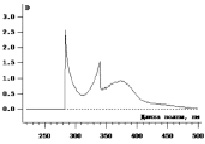
Рис. 3. УФ-спектр поглощения кислоты янтарной с раствором калия дихромата
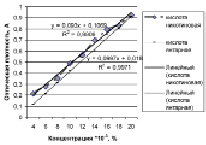
Рис. 4. График линейной зависимости кислоты янтарной и никотиновой
Таблица 1
Результаты количественного определения кислоты никотиновой и янтарной в модельных смесях спектрофотометрическим методом
|
№ образца |
Найдено кислоты никотиновой, г |
Валидационная оценка |
Найдено кислоты янтарной, г |
Валидационная оценка |
|
1 |
0,4985 |
SD = 5,72*10-2 |
0,0928 |
SD = 1,087*10-3 |
|
2 |
0,4973 |
RSD = 2,34*10-2 |
0,0937 |
RSD = 0,443*10-3 |
|
3 |
0,4898 |
∆Х = 6,01*10-2 |
0,0917 |
∆Х = 1,14*10-3 |
|
4 |
0,4963 |
ε = 1,219 % |
0,0929 |
ε = 1,24 % |
|
5 |
0,4887 |
0,0920 |
||
|
6 |
0,4894 |
0,0906 |
||
|
Х ср = 0,4932 |
Х ср = 0,0923 |
Таблица 2
Результаты количественного анализа модельных смесей суппозиториев с различным содержанием кислоты никотиновой
|
Проба |
Значение измеряемой величины в модельной смеси, г |
Значение, найденное экспериментально |
|
|
Абсолютная величина, г |
Процент восстановления, % |
||
|
1.1 |
0,3500 |
0,3493 |
99,80 |
|
1.2 |
0,3500 |
0,3485 |
99,57 |
|
1.3 |
0,3500 |
0,3491 |
99,74 |
|
2.1 |
0,5000 |
0,4892 |
97,84 |
|
2.2 |
0,5000 |
0,4923 |
98,46 |
|
2.3 |
0,5000 |
0,4886 |
97,72 |
|
3.1 |
0,6500 |
0,6452 |
99,26 |
|
3.2 |
0,6500 |
0,6471 |
99,55 |
|
3.3 |
0,6500 |
0,6429 |
98,91 |
|
Средний процент восстановления, % |
98,98 |
||
Для определения правильности методики применяли модельные смеси РСО кислоты никотиновой и янтарной в трех концентрациях в процентах относительно первоначального значения 70, 100, 130 %. Измерения проводили в трех повторностях для каждого значения концентрации, в соответствии с табл. 2 и 3.
Таблица 3
Результаты количественного анализа модельных смесей суппозиториев с различным содержанием кислоты янтарной
|
Проба |
Значение измеряемой величины в модельной смеси, г |
Значение, найденное экспериментально |
|
|
Абсолютная величина, г |
Процент восстановления, % |
||
|
1.1 |
0,0700 |
0,0683 |
97,57 |
|
1.2 |
0,0700 |
0,0691 |
98,71 |
|
1.3 |
0,0700 |
0,0679 |
97,00 |
|
2.1 |
0,1000 |
0,0984 |
98,40 |
|
2.2 |
0,1000 |
0,0961 |
96,10 |
|
2.3 |
0,1000 |
0,0955 |
95,50 |
|
3.1 |
0,1300 |
0,1261 |
97,00 |
|
3.2 |
0,1300 |
0,1284 |
98,80 |
|
3.3 |
0,1300 |
0,1277 |
98,23 |
|
Средний процент восстановления, % |
97,48 |
||
Полученный средний процент восстановления в трех проводимых концентрациях в трех повторностях составил 98,98 % и 97,48 % для кислоты никотиновой и янтарной, соответственно, что укладывается в допустимые пределы приемлемости 100 ± 5 %. Для установления достоверности методики использовали вариант «введено-найдено» на пяти значениях концентраций (табл. 4 и 5).
Таблица 4
Результаты количественного определения кислоты никотиновой в модельных смесях методом добавок
|
Содержание кислоты никотиновой в модельной смеси, г |
Добавлено кислоты никотиновой, г |
Содержание кислоты никотиновой, г |
Ошибка |
||
|
Расчетная, г |
Найденная, г |
Абсолютная, % |
Относительная, % |
||
|
0,4976 |
0,0500 |
0,5476 |
0,5453 |
– 0,0023 |
0,42 % |
|
0,4976 |
0,1000 |
0,5976 |
0,5923 |
– 0,0053 |
0,89 % |
|
0,4976 |
0,1500 |
0,6476 |
0,6434 |
– 0,0042 |
0,65 % |
|
0,4976 |
0,2000 |
0,6976 |
0,6905 |
– 0,0071 |
1,02 % |
|
0,4976 |
0,2500 |
0,7476 |
0,7451 |
– 0,0025 |
0,34 % |
Таблица 5
Результаты количественного определения кислоты янтарной в модельных смесях методом добавок
|
Содержание кислоты янтарной в модельной смеси, г |
Добавлено кислоты янтарной, г |
Содержание кислоты янтарной, г |
Ошибка |
||
|
Расчетная, г |
Найденная, г |
Абсолютная, % |
Относительная, % |
||
|
0,0926 |
0,0100 |
0,1026 |
0,1008 |
– 0,0018 |
1,94 % |
|
0,0926 |
0,0200 |
0,1126 |
0,1103 |
– 0,0023 |
2,48 % |
|
0,0926 |
0,0300 |
0,1226 |
0,1215 |
– 0,0011 |
1,19 % |
|
0,0926 |
0,0400 |
0,1326 |
0,1313 |
– 0,0013 |
1,40 % |
|
0,0926 |
0,0500 |
0,1426 |
0,1407 |
– 0,0019 |
2,05 % |
Кроме того, были определены прецизионность и сходимость методики проводили на спектрофотометре СФ 56 в разные дни одним и тем же специалистом на одной пробе в шести повторностях. Относительное стандартное отклонение не превысило 15 %. Критерий Стьюдента экспериментальный меньше табличного (2,57) в обоих случаях. Воспроизводимость методики определяли в двух лабораториях на приборах СФ-56 и СФ – 101 в шести повторностях . На основании полученных данных было установлено, что данная методика может быть применена для количественной оценки высвобождения производных карбоновых кислот из лекарственных форм.
При разработке методики количественного определения использовали обращено – фазовый вариант ВЭЖХ. Были подобраны условия хроматографирования для кислоты никотиновой и установлено, что оптимальный состав подвижной фазы – ацетонитрил – воды (70:30), длина волны детектирования составила 260 нм. В данных условиях получен достаточно четкий пик кислоты никотиновой с временем удерживания 1,5 минут (рис. 5). Для выбора оптимальных условий изучили влияние рН на хроматографический процесс. Результаты представлены в табл. 6.
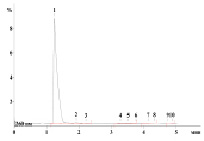
Рис. 5. Хроматограмма кислоты никотиновой при 260 нм
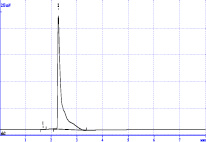
Рис. 6. Хроматограмма кислоты янтарной при 210 нм
Таблица 6
Параметры хроматографической системы для определения кислоты никотиновой в зависимости от величины рН
|
рН |
Время удерживания, сек. tR |
Коэффициент емкости, k/ |
Эффективность, N |
Фактор асимметрии, As |
|
4,0 |
108 |
2,6 |
74649 |
1,47 |
|
5,0 |
105 |
2,4 |
74267 |
1,87 |
|
6,0 |
107 |
2,6 |
73281 |
1,88 |
|
8,0 |
108 |
2,6 |
73974 |
1,87 |
|
9,0 |
114 |
2,5 |
72876 |
1,94 |
|
10,0 |
114 |
2,6 |
72761 |
1,92 |
Установлено, что с увеличением значения рН увеличивается коэффициент асимметрии на фоне снижения эффективности разделения. При этом величина рН не оказывает существенного воздействия на время удерживания и коэффициент емкости.
Для анализа кислоты янтарной нами также были изучены условия хроматографического определения. Установлено, что коэффициент гидрофобности составляет – 1,65, что свидетельствует о гидрофильности молекулы. Поэтому за основу брали методику, предложенную для количественного определения карбоновых кислот в различных напитках. В качестве элюента использовали кислоту серную в концентрации 0,005 – 0,2 моль/л. Скорость подачи элюента варьировала от 50 до 200 мкл/мин. В качестве длины волны детектирования использовали 210 нм, поскольку в данной области кислота янтарная обладают некоторым светопоглощением. Установлено, что время удерживания кислоты янтарной составляет 2,5 минуты (рис. 6).
Данные методики были апробированы и валидированы для разработанных лекарственных форм. Результаты представлены в табл. 7.
Таблица 7
Результаты количественного определения кислоты янтарной и никотиновой методом ВЭЖХ
|
Показатель |
Кислота янтарная |
Кислота никотиновая |
|
Линейность |
y = 16,057х + 15,467; R2 = 0,9931 |
y = 24,6х + 23,4; R2 = 0,9988 |
|
Прецизионность |
RSD = 2,94*10-4 |
RSD = 0,65*10-4 |
|
Правильность |
R = 100,13 % |
R = 97,85 |
|
Содержание, г ( х ср ± SD) |
0,09821 ± 0,00072 |
0,4892 ± 0,00016 |
Выводы
1. Предложено использование калия дихромата в качестве внешнего стандарта при проведении биофармацевтических исследований для контроля высвобождения кислоты никотиновой и янтарной из суппозиториев.
2. Изучены хроматографические параметры и предложен метод ВЭЖХ для количественной оценки кислоты янтарной и никотиновой в суппозиториях.

