Проблема утилизации диоксида серы из отходящих газов весьма актуальна как с экологической, так и с экономической точки зрения. Для решения этой задачи было предложено и разработано много технических мероприятий, часть из которых осуществлены на крупных промышленных объектах. Однако в настоящее время еще нет универсального метода извлечения и использования диоксида серы, который при любых условиях обладал бы бесспорными преимуществами перед другими. Для разных промышленных объектов в зависимости от конкретных технико-экономических условий наиболее эффективными оказываются различные методы. Появились качественно новые источники отходящих газов, содержащие концентрированный сернистый газ. Такие сернистые газы получаются главным образом на предприятиях цветной металлургии. Наибольшего внимания заслуживают отходящие газы, получаемые при кислородно-взвешенной плавке медных концентратов и кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых концентратов. Концентрация диоксида серы в таких отходящих газов доходит до 80 – 90 %. Такие газы эффективно и с максимальной выгодой можно использовать, комбинируя производства серной и азотной кислот [3].
В производствах серной кислоты нитрозным способом и азотной кислоты существует очевидная родственность, как в аппаратурном оформлении, так и в самом химизме процесса. Усилия, направленные отдельно в каждой отрасли промышленности, помешали учесть и использовать взаимные выгоды совмещения этих производств.
Проведенные исследования по денитрации нитрозной серной кислоты, содержащей 1,76 – 4,00 % N2O3, концентрированном сернистым газом показали, что уменьшение массовой доли серной кислоты до 74 – 73 % вызывает значительное увеличение интенсивности переработки диоксида серы нитрозой [1]. Ниже этой концентрации рост указанной величины замедляется и ход кривых меняет свое направление. Благоприятное влияние на регенерацию оксидов азота в башенной системе при уменьшении концентрации нитрозы до содержания 73 % H2SO4 отмечали также и другие исследователи [5].
В связи с исследованием денитрации нитрозной серной кислоты с использованием отходящих концентрированных сернистых газов предприятия цветной металлургии и расчета оборудования процесса денитрации возникла необходимость определения равновесного парциального давления оксидов азота и азотной кислоты над нитрозой, содержащей серную кислоту 73 %.
Цель исследования
Исследовать равновесные парциальные давления оксидов азота (II) и (III), азотной кислоты в нитрозе, содержащей 0,5 – 4,0 % N2O3, 0,10 – 1,04 % HNO3, с массовой долей исходной серной кислоты 73 % в интервале температур 293 – 433 К.
Материалы и методы исследования
Для расчета колонны денитрации необходимо знание равновесного парциального давления оксидов азота и азотной кислоты над нитрозой с массовой долей серной кислоты 73 %. Такое исследование было выполнено в интервале температур 293 – 433 К и нитрозности кислоты 0,5 – 4,0 % N2O3. При этом содержание азотной кислоты менялось от 1,04 % при нитрозности 4,0 % N2O3 и 0,58 % при нитрозности 2,5 % N2O3 до 0,18 % при нитрозности 1,5 % N2O3 и 0,10 % при нитрозности 0,5 % N2O3. В известных источниках информации такие данные отсутствуют.
Растворы для исследования готовили путем растворения кристаллов нитрозилсерной кислоты в серной кислоте с исходной концентрацией 73 % H2SO4.
Известно [4], что в нитрозе, исходная серная кислота которой 73 % H2SO4, происходит распад азотистой кислоты, образующейся при гидролизе нитрозилсерной кислоты на азотную кислоту и оксид азота (II) по уравнению
3 HNO2 → HNO3 + 2NO + H2O
Соответственно в растворе появляется свободная азотная кислота. Чем выше содержание оксида азота (III), тем больше концентрация свободной азотной кислоты в нитрозе.
Установка и методика исследования, анализа и обработки полученных данных описаны ранее [2].
Результаты исследования и их обсуждение
Впервые были определены равновесные парциальные давления не только оксида азота (III) и азотной кислоты, но и оксида азота (II). На рис. 1–4 представлены графики зависимостей парциальных давлений N2O3, HNO3, NO и суммарного давления оксидов азота от температуры при концентрации исходной серной кислоты 73 %.
При нитрозности раствора 0,5 % N2O3 и 0,10 % HNO3 повышение температуры с 293 до 373 и 433 К равновесные парциальные давления оксида азота (II) возрастает с 0,01 до 0,05 и 0,09 кПа (в 5 и 9 раз), оксида азота (III) – с 0,2 до 1,4 и 9,1 кПа (в 7 и 45,5 раз), азотной кислоты с 0,06 до 0,5 и 2 кПа (в 8,3 и 33,3 раз), а суммарное давление с 0,27 до 1,95 и 11,19 кПа (в 7,2 и 41,4 раз). При нитрозности 1,5 % N2O3 и 0,18 % HNO3 при тех же условиях парциальное давление оксида азота (II) возрастает с 0,01 до 0,08 и 0,14 кПа (в 8 и 14 раз), оксида азота (III) – с 0,4 до 2,4 и 11,4 кПа (в 6 и 28,5 раз), азотной кислоты – с 0,1 до 0,8 и 3,6 кПа (в 8 и 36 раз), а суммарное давление с 0,51 до 3,28 и 15,14 кПа (в 6,4 и 29,7 раз).
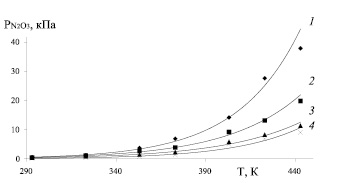
Рис. 1. Зависимость парциального давления паров N2O3 от температуры при концентрации серной кислоты 73 % и при концентрации N2O3: 1 – 4,0 %; 2 – 2,5 %; 3 – 1,5 %; 4 – 0,5 %
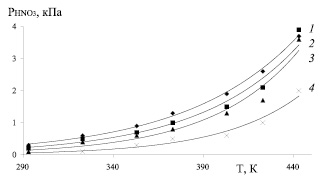
Рис. 2. Зависимость парциального давления паров HNO3 от температуры при концентрации серной кислоты 73 % и при концентрации N2O3: 1 – 4,0 %; 2 – 2,5 %; 3 – 1,5 %; 4 – 0,5 %
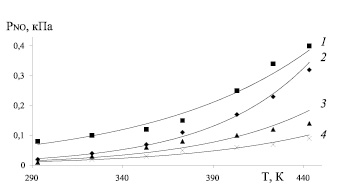
Рис. 3. Зависимость парциального давления паров NO от температуры при концентрации серной кислоты 73 % и при концентрации N2O3: 1 – 4,0 %; 2 – 2,5 %; 3 – 1,5 %; 4 – 0,5 %
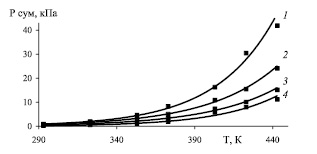
Рис. 4. Зависимость суммарного давления паров от температуры при концентрации серной кислоты 73 % при концентрации N2O3: 1 – 4,0 %; 2 – 2,5 %; 3 – 1,5 %; 4 – 0,5 %
Значения коэффициентов
|
a |
b |
c |
d |
e |
f |
g |
h |
|
|
РN2O3 |
– 0,0003 |
0,00251 |
– 0,0057 |
0,0139 |
– 0,1022 |
0,9068 |
– 2,2881 |
5,0201 |
|
РHNO3 |
0,0001 |
– 0,0007 |
0,0004 |
0,0098 |
0,030 |
– 0,1181 |
– 0,4639 |
4,3343 |
|
РNO |
0,0011 |
– 0,00677 |
0,011 |
0,0022 |
0,5101 |
– 3,0818 |
4,6782 |
2,0722 |
|
Рсум |
– 0,0002 |
0,00178 |
– 0,0044 |
0,013 |
– 0,0473 |
0,5385 |
– 1,7018 |
4,5603 |
При нитрозности 2,5 % N2O3 и 0,58 % HNO3 парциальные давления оксида азота (II) возрастает с 0,02 до 0,11 и 0,32 кПа (в 5,5 и 16 раз), оксида азота (III) – с 0,5 до 3,9 и 19,8 кПа (в 7,8 и 39,6 раз), азотной кислоты с 0,2 до 1,0 и 3,9 кПа (в 5 и 19,5 раз), а суммарное давление с 0,72 до 5,01 и 24,06 кПа (в 7 и 33,4 раз). При нитрозности 4,0 % N2O3 и 1,04 % HNO3 парциальные давления оксида азота (II) возрастает с 0,08 до 0,15 и 0,40 кПа (в 1,9 и 5 раз), оксида азота (III) – с 0,6 до 6,9 и 37,8 кПа (в 11,5 и 63 раз), азотной кислоты с 0,3 до 1,3 и 3,7 кПа (в 4,3 и 12,3 раз), а общее давление с 0,98 до 8,35 и 41,90 кПа (в 8,5 и 42,8 раз).
По полученным экспериментальным данным было выведено эмпирическое уравнение для определения как равновесного парциального давления оксидов азота и азотной кислоты, так и суммарного давления паров во всем исследованном диапазоне изменения компонентов.
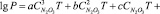
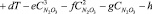 ,
,
где Р – равновесное парциальное давление, кПа; Т – температура, К; 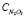 – содержание N2O3 в нитрозе, % масс.
– содержание N2O3 в нитрозе, % масс.
Значения коэффициентов приведены в таблице.
Максимальное отклонение расчетных данных от экспериментальных не превышает ± 8 %.
Полученные экспериментальные данные можно использовать для расчета оборудования процесса денитрации и выяснения механизма гидролиза нитрозилсерной кислоты.
Выводы
1. Изучены равновесные парциальные давления оксидов азота и азотной кислоты над нитрозой, содержащей 0,5 – 4,0 % N2O3, 0,10 – 1,04 % HNO3, 73 % H2SO4 в интервале температур 293 – 433 К.
2. Выведено эмпирическое уравнение для расчета парциальных давлений оксидов азота и азотной кислоты, а также суммарное давление в изученном интервале изменения параметров процессов.

