Российский Федеральный закон «Об обращении лекарственных средств» вводит понятие воспроизведенного лекарственного средства, однако входит в некоторое противоречие с документами других стран. В соответствии с Федеральным законом Российской Федерации от 12 апреля 2010 г. N 61-ФЗ» при проведении процедуры экспертизы воспроизведенных лекарственных средств должна быть представлена информация, полученная при проведении клинических исследований лекарственных препаратов и опубликованная в специализированных печатных изданиях, а также документы, содержащие результаты исследования биоэквивалентности и (или) терапевтической эквивалентности. Если говорить об исследованиях терапевтической эквивалентности лекарственных препаратов, то под этим термином понимается достижение клинически сопоставимого терапевтического эффекта при применении лекарственных препаратов для медицинского применения для одной и той же группы больных по одним и тем же показаниям к применению [1, 2].
Несмотрям на важность показателей биоэквивалнтности при регистрации воспроизведенного лекарственного препарата, результаты клинических исследований для доказательства терапевтической эквивалентности сохраняют определенную значимость.
Есть данные, которые подтверждают отсутствие терапевтической эквивалентности (ТЭ) лекарственных препаратов (ЛП) при доказанной биоэквивалентности. Так, при иследовании клинической эффективности четырех воспроизведенных препаратов эналаприла с референтным препаратом они оказались терапевтически неэквивалентны при доказанной фармацевтической и биоэквивалентности [3].
Если говорить об антиаритмических препаратах (ААП), то эта группа препаратов обладает узким терапевтическим диндексом [4], что по данным FDA является фактором определяющим проведение оценки ТЭ.
Современные представления об эффективности и безопасности лечения антиаритмическими препаратами базируются в первую очередь на сведениях о влиянии препаратов на так называемые «конечные точки»: общую смертность и внезапную смерть пациентов. В работе F.T. McAlister и K.K. Teo [5] изучены результаты многочисленных исследований, посвященных антиаритмической терапии. Авторы приходят к следующим выводам:
– профилактическое назначение препаратов I класса (мембраностабилизаторов) у больных высокого риска, преимущественно перенесших инфаркт миокарда (ИМ) связано с достоверным повышением риска смерти (61 исследование, 23486 больных);
– препараты II класса, бета-адреноблокаторы, значительно снижают риск смерти у больных после ИМ (56 исследований, 53521 больной);
– данные о лечении больных высокого риска (после ИМ миокарда, с сердечной недостаточностью [СН по классификации NYHY], переживших остановку сердца) препаратом III класса амиодароном подтверждают его эффективность в снижении риска смерти (14 исследований, 5713 больных);
– препараты IV класса, блокаторы медленных кальциевых каналов, не снижают у пациентов риск внезапной смерти (26 исследований, 21644 больных).

Рис. 1. Изменение сывороточной концентрации амиодарона (мг/л) после замены Кордарона на дженерик у 28-летнего мужчины с желудочковой тахикардией
Из этих данных следует, что лишь препараты, обладающие свойствами антиаритмиков II и III класса, снижают риск внезапной смерти, то есть имеют как антиаритмическую, так и антифибрилляторную активность. Подтверждением этому могут служить результаты большого числа многоцентровых исследований, таких, как MIAMI, GMT, SMT, BASIS, EMIAT, EPASMA, SSSD.
Далее мы приводим ряд клинических исследований воспроизведенных препаратов амиодарона, который является «золотым стандартом» антиаритмических лекарственных препаратов.
После появления первых дженериков амиодарона в литературе были опубликованы сообщения о фармакологических и клинических аспектах замены оригинального препарата на его копии. S. Sauro и соавт. [6] сопоставили равновесные концентрации амиодарона и дезэтиламиодарона у 138 пациентов, принимавших Кордарон в стабильной дозе, а затем перешедших на лечение дженериком амиодарона. Равновесные уровни амиодарона и его метаболита достоверно не изменились после замены оригинального препарата дженериком, однако вариабельность концентрации препарата в плазме увеличилась. По мнению авторов, в течение 1-3 месяцев после смены препарата целесообразно контролировать концентрации действующего вещества в плазме (в России эта рекомендация практически не выполнима).
J. Reiffel и P. Kowey [7] провели опрос 130 ведущих американских аритмологов, которым предлагали сообщить, наблюдали ли они рецидивы аритмий при замене оригинальных антиаритмических препаратов на дженерики. На поставленные вопросы ответили 64 специалиста. Около половины из них наблюдали эпизоды аритмий (включая фибрилляцию желудочков, желудочковую тахикардию, фибрилляцию предсердий и предсерную тахикардию), которые были определенно или вероятно связаны с заменой оригинального препарата. В целом было зарегистрировано 54 рецидива аритмий, включая 32 случая при замене Кордарона на дженерик амиодарона. Три пациента умерли (в том числе пациент, получавший амиодарон). Кроме того, эксперты наблюдали 7 случаев аритмогенного действия дженериков (один из них был зарегистрирован при применении дженерика амиодарона, хотя этот препарат характеризуется низкой аритмогенной активностью). В части случаев связь между рецидивами аритмий и заменой антиаритмического препарата была подтверждена при повторной провокации или анализе сывороточных уровней лекарственных веществ в плазме (рис. 1).
Таким образом, около половины респондентов сталкивались с проблемами при смене антиаритмического препарата, причем во всех этих случаях оригинальный препарат заменяли на его копию.
P. Pollak [8] определял концентрации амиодарона и его активного метаболита десэтиламиодарона у 77 пациентов, длительно принимавших Кордарон. После начала лечения отношение концентраций метаболита и амиодарона увеличивалось примерно до 0,9 и не зависело от дозы препарата. Этот показатель редко превышал 1,4, а его увеличение ассоциировалось с токсическими изменениями со стороны легких. У 4 пациентов замена оригинального Кордарона на дженерик сопровождалась значительным увеличением отношения уровней дезэтиламиодарона и амиодарона (рис. 2). Например, у 42-летнего мужчины, принимавшего Кордарона по поводу предсердной тахикардии, через 1 месяц после назначения дженерика указанный коэффициент увеличился с 0,8 до 1,8. После возобновления приема Кордарона он снизился до 1,1. Еще одна попытка замены оригинального препарата вновь привела к увеличению отношения уровней метаболита амиодарона до 1,6. Следует отметить, что во всех 4 случаях относительные изменения концентраций метаболита существенно превышали 20 % (максимальный показатель для биоэквивалентного дженерика). Для подтверждения биоэквивалентности дженериков амиодарона не требуется анализ активного метаболита этого препарата, хотя изменения его уровня могут отражаться на эффективности и безопасности лечения.
Сходные проблемы наблюдались и при применении других антиаритмических препаратов. B. Grubb [9] описал рецидив желудочковой тахикардии после замены оригинального прокаинамида на дженерик. При обследовании было выявлено снижение сывороточной концентрации действующего вещества до 2,4 мг/мл (эффективный уровень – около 10 мг/мл). Т. Ozahowski и соавт. [10] наблюдали 2 случая рецидивирующей наджелудочковой тахикардии у пациентов с имплантированным кардиовертером-дефибриллятором, получавших дженерик прокаинамида замедленного высвобождения. Контроль аритмии был восстановления после возобновления приема оригинального препарата. В описанном выше исследовании J. Reiffel и P. Kowey [11], которые проводили опрос американских аритмологов, рецидивы аритмий или аритмогенные эффекты отмечались при смене препаратов не только амиодарона, но и прокаинамида, хинидина, дизопирамида.
Приведенные данные могут показаться не очень убедительными. На самом деле они представляют собой описания отдельных случаев, а не результаты рандомизированных контролируемых исследований. Однако известно, что именно постмаркетинговое наблюдение позволяет выявить серьезные нежелательные последствия или взаимодействия лекарственных средств, которые могут быть даже причиной прекращения их маркетинга (примерами могут служить антигистаминные препараты терфенадин и астемизол, статин церивастатин и др.). Последнее обычно происходит, если имеются более безопасные представители того же класса. Распознать нежелательные эффекты замены оригинального антиаритмического препарата на дженерики в клинической практике очень сложно, особенно при отсутствии четкой хронологической зависимости [12].
Врачи обычно не придают особого значения тому, какой препарат применяется – оригинальный или воспроизведенный. При этом рецидив аритмии, скорее всего, будет расценен как следствие прогрессирования основного заболевания, а не смены препарата. Подтверждением этой связи могут быть изменения концентрации действующего вещества и/или его метаболитов в крови, однако на практике врачу проще отменить соответствующий препарат, чем провести эти исследования. J. Reiffel [13] предложил следующие рекомендации по замене оригинальных антиаритмических препаратов на воспроизведенные:
- заменять антиаритмические препараты не следует у пациентов с угрожающими жизни аритмиями, аритмиями, которые могут вызвать потерю сознания, а также в тех случаях, когда повышение уровней лекарственного вещества в крови может привести к аритмогенному действию;
– не следует заменять антиаритмические препараты, биотрансформирующиеся до множественных метаболитов или метаболитов, которые нельзя определить;
– при менее серьезных аритмиях дженерики можно применять только в тех случаях, когда имеется простой и надежный метод мониторирования их концентрации;
– при необходимости замены следует тщательно контролировать уровни препарата в крови.
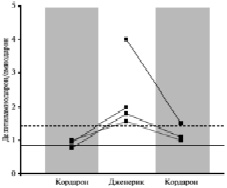
Рис. 2. Изменения отношения уровней дэзэтиламиодарона/амиодарона при замене Кордарона на джененики. Сплошная линия – средний показатель у 77 пациентов, пунктирная – 95-й перцентиль
Если снижение или повышение концентрации антиаритмического препарата может привести к угрожающим жизни последствиям, замена оригинального препарата возможно только в следующихслучаях:
– зарегистрирован только один воспроизведенный препарат и, соответственно, отсутствует риск многочисленных замен;
– воспроизведенный препарат широко доступен в стационарах и аптечной сети.
Если выполнять все эти рекомендации, то от применения воспроизведенных антиаритмических препаратов пришлось бы полностью отказаться как при легких (из-за невозможности мониторирования концентраций в крови), так и серьезных нарушениях ритма. На практике следует, вероятно, придерживаться следующей тактики ведения. Если пациент получает антиаритмическую терапию оригинальным препаратом с хорошим эффектом, то заменять его на воспроизведенный препарат не следует. Если по экономическим причинам замена оригинального антиаритмического препарата все же необходима, то пациент должен находиться под наблюдением, чтобы убедиться в сохранении достигнутого ранее эффекта. При рецидиве аритмии или ухудшении переносимости можно попытаться возобновить прежнюю терапию. В любом случае целесообразно избегать частых замен копий оригинального препарата. Единственным основанием для замены оригинального препарата на воспроизведенный являются экономические соображения. Соответственно, возникает вопрос – какова экономия затрат при замене Кордарона на дженерики? Розничная стоимость упаковки Кордарона (30 таблеток по 200 мг), которой достаточно на месяц поддерживающей терапии, составляет около 250 рублей. Стоимость дженериков примерно в 2-3 раза ниже. Следовательно, экономия составит не более 150-180 рублей в месяц. Вряд ли, указанная сумма оправдывает возможные последствия подобной модификации антиаритмической терапии. Необходимо учитывать, что ухудшение эффективности и переносимости лечения приводит к росту затрат (госпитализации, дополнительные визиты к врачу, вызов скорой помощи и т.п.), поэтому в конечном итоге общая стоимость лечения может даже увеличиться [12]. По мнению P. Pollak [8], если только 5 % больных, получающих амиодарон в США и Канаде, потребуется одна госпитализация, связанная с заменой оригинального препарата на воспроизведенный, то общее число таких госпитализаций составит 20000 в год.
Заключение
На примере амиодарона очевидно, что проведение качественных исследований терапевтической эквивалентности воспроизведенных антиаритмических лекарственных препаратов очень важно для обеспечения эффективности, безопасности, экономической выгоды применения антиаритмических лекарственных препартов, а в ряде случаев может спасти жизнь пациента.

