Представители крупного семейства гвоздичные (Caryophyllaceae Juss.) включающего более 100 родов и свыше 2500 видов широко распространены в зоне умеренного климата преимущественно северного полушария (Средиземноморья), Средней Азии, заходят в тропики, особенно в горные районы, некоторые встречаются и в Арктике [5]. Это однолетние, двулетние или многолетние травы, реже кустарнички. Первые виды семейства были описаны в работах ещё долиннеевских авторов (Турнефор, Буксбаум и др.). Однако основа научного подхода к изучению растений, в том числе и семейства гвоздичных, заложены в работах К. Линнея. Он распределил виды, относящиеся в настоящее время к семейству между несколькими классами своей системы. Описание таксона как семейства сделал А.Л. Жюсье в 1789 г. [7]. Со времён Линнея и до наших дней был накоплен значительный гербарный материал, который тщательно изучался и изучается многими крупнейшими систематиками мира. В настоящее время большинство из них принимает единое семейство Caryophyllaceae Juss., разделяя его на три подсемейства: алсиновые (Alsinoideae Vierh.), смолёвковые (Silenoideae A. Br.) и паронихиевые (Paronichioideae Vierh.) [7]. Химический состав семейства в целом и его отдельных подсемейств изучен недостаточно. Из видов подсемейств выделены и идентифицированы различные классы природных соединений, таких как: флавоноиды, среди которых производные флавона (апигенин, лютеолин и их аналоги); флавонола (кверцетин, кемпферол, изорамнетин и их гликозиды); кумарины и оксикумарины (герниарин, умбеллиферон и др.); сапонины, агликонами которых являются гипсогенин, гипсогеновая и квилаевые кислоты и т.д.; оксикоричные кислоты (кофейная, н-оксикоричная и др.). Замечено, что подсемейства Alsinoideae и Silenoideae по составу флавоновых гликозидов и других фенольных соединений стоят ближе друг к другу, чем к подсемейству Paronichioideae, хотя многосемянные роды последнего (Spergula L., Spergularia (Pers.) J. et C. Presl, Alsine L., Telephium L., Polycarpon L.) также близки к подсемейству Alsinoideae. Только роды Paronichiа Mill., Herniaria L. и, по-видимому, Pteranthus Forssk. по химическому составу располагаются изолированно [4]. Особенно большое значение приобретают вещества стероидной природы экдистероиды (рис. 1) – гормоны линьки насекомых, обладающие рядом ценнейших свойств [1, 2, 6, 8, 9]. Эти соединения очень характерны для семейства гвоздичных, равно как и флавоноид виценин (рис. 3) (6,8-С-β-D-диглюкопиранозид апигенина) и антоцианы (рис. 2), которые наряду с другими веществами (сапонины) могут свидетельствовать о принадлежности исследуемых видов растений к семейству гвоздичных [4].
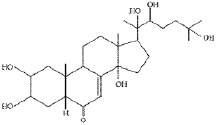
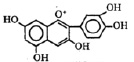
Рис. 1. Структура полиподин В Рис. 2. Структура цианидина
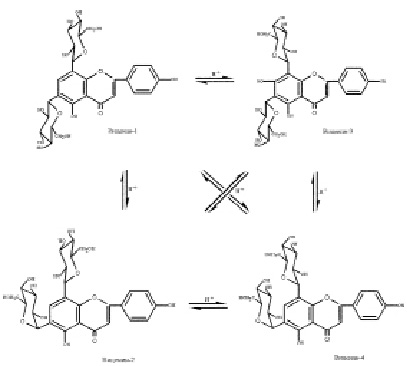
Рис. 3. Ротационная изомеризация С-дигликозидов апигенина (виценина) (получены при обработке виценина слабым раствором кислоты хлористоводородной)
Цель исследования – проанализировать химический состав некоторых видов растений семейства гвоздичные методом ВЭЖХ.
Материалы и методы исследования
При изучении растений использовали гербарный материал, полученный нами из различных Гербариев стран СНГ. Химическое изучение растений проводили с помощью ВЭЖХ-спектрометрии, используя хроматограф фирмы «Gilston», модель 305, Франция; инжектор ручной, модель «Rheodine» 7125, США, с последующей компьютерной обработкой материалов исследования с помощью программы «Мультихром» для «Windows». Подвижная фаза – ацетонитрил:вода:кислота фосфорная (200:300:0,5); неподвижная фаза – металлическая колонка, размером 4,6×250 мм, Kromasil C 18, размер частиц 5 микрон; температура комнатная; скорость подачи элюанта 0,5 мл/мин.; продолжительность анализа 60 мин. Детектирование проводили с помощью УФ-детектора «Gilston» UV/VIS, модель 151, при длине волны 245 нм.
Для исследования брали около 1,5 г сырья изучаемых нами растений, в колбе на 150 мл извлекали БАВ 20 мл спирта этилового 70 %-ного на водяной бане с обратным холодильником в течение 1 часа. Смесь фильтровали в мерную колбу на 25 мл и доводили объём до метки 70 %-ным спиртом этиловым (исследуемый раствор А). Параллельно готовили серию 0,05 %-ных растворов сравнения в 70 %-ном спирте этиловом: 25 индивидуальных фенольных соединений, а также экдистероидов, экдистерона и полиподина В. По 20 мкл исследуемых растворов и растворов сравнения вводили в хроматограф и хроматографировали в вышеприведённых условиях. Для количественного определения очень важных в химическом и таксономическом отношении соединений виценина и полиподина В параллельно готовили растворы стандартного образца (РСО) виценина и полиподина В в 70 %-ном спирте этиловом. Для этого около 0,020 г (точная навеска) виценина и полиподина В помещали в мерную колбу на 25 мл, прибавляли 20 мл спирта этилового 70 %-ного, перемешивали до растворения и доводили объём до метки тем же растворителем (РСО). По 20 мкл исследуемого раствора и растворов РСО вводили в хроматограф и хроматографировали по приведённой выше методике. Расчёт количественного содержания виценина и полиподина В производили методом абсолютной калибровки с помощью компьютерной программы «Мультихром» для «Windows» и формулы:
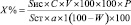 ,
,
где Sис – площадь пика виценина или полиподина В в исследуемом растворе; Sст – площадь пика стандартного раствора (РСО) виценина или полиподина В; X % – концентрация виценина или полиподина В в %; C – концентрация РСО виценина или полиподина В в г/мл; a – навеска исследуемого образца; W – потери в массе при высушивании в %; P – чистота стандартов виценина или полиподина В.
Результаты исследования и их обсуждение
В результате проведённых исследований растений нами изучен химический состав некоторых полифенольных и стероидных соединений, данные приведены в табл. 1, 2, 3; на рис. 4.
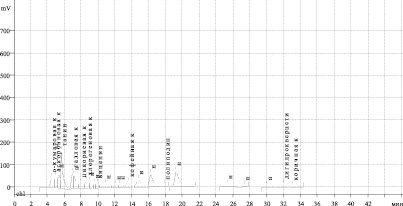
Рис. 4. Хроматограмма ВЭЖХ водно-спиртового извлечения из травы телефиума восточного (детектирование при длине волны 245 нм)
Таблица 1
|
Растение |
Навеска, г |
Объём извлечения А, мл |
Объём извлечения для введения в хроматограф |
Найдено в % |
|
|
виценин |
полиподин В |
||||
|
гастролихнис трёхцветковый Gastrolychnis triflora (A.Br.) Tolm. |
0,320 |
25 |
1 мл А до 5 мл подвижной фазой |
- |
0,240 |
|
туника прямая Tunica stricta (Bunge) Fich. |
0,350 |
25 |
1 мл А до 5 мл подвижной фазой |
0,560 |
0,300 |
|
кверия испанская Queria hispanica L. |
0,263 |
25 |
1 мл А до 5 мл подвижной фазой |
0,460 |
0,510 |
|
телефиум восточный Telephium orientale Boiss. |
0,443 |
25 |
1 мл А до 2 мл подвижной фазой |
0,480 |
0,023 |
Таблица 2
Результаты идентификации некоторых полифенольных и стероидных соединений телефиума восточного (водно-спиртового извлечение, детектирование при длине волны 245 нм)
|
№ п/п |
Время, мин |
Высота, mV |
Площадь, mV*сек |
ФО |
Конц., % |
Название соединения |
|
1 |
4.429 |
42.29 |
1182.36 |
1.000 |
5.53 |
о-кумаровая кислота |
|
2 |
4.839 |
45.37 |
1132.84 |
1.000 |
5.29 |
аскорбиновая кислота |
|
3 |
5.27 |
65.82 |
1149.65 |
1.000 |
5.37 |
неидентифицированное соединение |
|
4 |
5.588 |
164.61 |
2342.84 |
1.000 |
10.95 |
танин |
|
5 |
6.856 |
71.26 |
1009.06 |
1.000 |
4.72 |
галловая кислота |
|
6 |
7.056 |
58.66 |
1419.65 |
1.000 |
6.64 |
неидентифицированное соединение |
|
7 |
7.871 |
22.35 |
849.43 |
1.000 |
3.97 |
цикориевая кислота |
|
8 |
8.608 |
31.57 |
839.38 |
1.000 |
3.92 |
хлорогеновая кислота |
|
9 |
8.92 |
27.86 |
652.06 |
1.000 |
3.05 |
неидентифицированное соединение |
|
10 |
9.451 |
18.71 |
354.12 |
1.000 |
1.66 |
неидентифицированное соединение |
|
11 |
9.763 |
18.91 |
444.69 |
1.000 |
2.08 |
виценин |
|
12 |
10.79 |
13.31 |
1197.44 |
1.000 |
5.60 |
неидентифицированное соединение |
|
13 |
12.03 |
10.57 |
467.62 |
1.000 |
2.19 |
неидентифицированное соединение |
|
14 |
12.54 |
9.94 |
368.46 |
1.000 |
1.72 |
неидентифицированное соединение |
|
15 |
13.53 |
21.77 |
980.12 |
1.000 |
4.58 |
кофейная кислота |
|
16 |
14.71 |
30.58 |
1437.15 |
1.000 |
6.72 |
неидентифицированное соединение |
|
17 |
16.16 |
53.49 |
1816.36 |
1.000 |
8.49 |
неидентифицированное соединение |
|
18 |
17.77 |
2.38 |
71.95 |
1.000 |
0.34 |
полиподин В |
|
19 |
19.2 |
66.41 |
2534.65 |
1.000 |
11.85 |
неидентифицированное соединение |
|
20 |
25.28 |
7.52 |
362.38 |
1.000 |
1.69 |
неидентифицированное соединение |
|
21 |
27.34 |
1.06 |
28.01 |
1.000 |
0.13 |
неидентифицированное соединение |
|
22 |
29.95 |
1.56 |
75.16 |
1.000 |
0.35 |
неидентифицированное соединение |
|
23 |
31.85 |
8.36 |
451.19 |
1.000 |
2.11 |
дигидрокверцетин |
|
24 |
33.03 |
4,03 |
228.40 |
1.000 |
1.07 |
коричная кислота |
|
25 |
46.1 |
798.41 |
21395.00 |
0,250 |
100.00 |
Таблица 3
Результаты идентификации некоторых полифенольных и стероидных соединений в растений (водно-спиртового извлечение, детектирование при длине волны 245 нм)
|
Растение |
Идентифицированные соединения |
Неидентифицированные соединения |
Важнейшие идентифицированные полифенольные соединения |
Идентифицированные экдистероиды |
|
гастролихнис трёхцветковый Gastrolychnis triflora (A.Br.) Tolm. |
15 |
7 |
виценин, изовитексин, дигидрокверцетин |
полиподин В |
|
туника прямая Tunica stricta (Bunge) Fich. |
12 |
4 |
виценин, витексин |
полиподин В |
|
кверия испанская Queria hispanica L. |
15 |
15 |
виценин, рутин |
полиподин В |
|
телефиум восточный Telephium orientale Boiss. |
11 |
13 |
виценин, дигидрокверцетин |
полиподин В |
Для примера приводим хроматограмму ВЭЖХ водно-спиртового извлечения из травы телефиума восточного (рис. 4).
Ряд пиков остался неидентифицированым, что даёт повод продолжить изучение качественного состава травы изучаемых растений.
Выводы
Таким образом, работа показала, что в растениях родов гастролихнис, кверия, туника, телефиум присутствует фитоэкдистероид полиподин В, что не позволяет согласиться с мнением некоторых исследователей [3], что эти растения не содержат экдистероидов (равно как и многие другие виды гвоздичных). В телефиуме восточном экдистероиды найдены впервые из всего подсемейства паронихиевых семейства гвоздичных. Работа в этом направлении продолжается.

