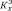Биоактивные препараты включают в себя большой класс веществ, оказывающих сильное воздействие на молекулярном уровне на биологические структуры и живые организмы. К ним относятся, в частности, различные фармацевтические препараты, стимуляторы процессов жизнедеятельности, аминокислоты, токсические вещества и др. Для эффективного использования биоактивных препаратов необходимо обеспечение соответствия их молекулярной структуры и состава номинальным препаратам, воздействие которых на биологические структуры и живые организмы надёжно установлено.
В связи с этим возникает задача установления на количественном уровне степени соответствия молекулярной структуры и состава реальных образцов, используемых в медицине, пищевой промышленности, сельском хозяйстве и других областях, с номинальными биоактивными препаратами, характеристики которых известны и введены в базу данных. Для решения такой задачи могут быть использованы спектроскопические методы, включая флуоресцентную спектроскопию, метод комбинационного рассеяния света, нелинейно-оптической спектроскопии и т.д. [1, 2]. Для однозначного ответа на вопрос о степени соответствия молекулярной структуры и состава анализируемого реального объекта номиналу, характеристики которого присутствуют в базе данных, необходимо провести на количественном уровне сравнение спектров анализируемого и номинального объекта.
Целью данной работы явилось сравнения спектров фотолюминесценции и коэффициентов корреляции анализируемых и номинальных биоактивных препаратов на примере коммерческих фармацевтических препаратов, различных производителей.
Материалы и методы исследования
В качестве объектов исследования нами были выбраны типичные фармацевтические препараты (цитрамон, анальгин, аспирин и парацетамол). В структурах всех исследованных веществ, присутствуют ароматические кольца, что приводит к фундаментальному электронному поглощению этих соединений в среднем ультрафиолетовом диапазоне. Соответственно в этих веществах наблюдается фотолюминесценция в фиолетово-красном диапазоне при возбуждении образцов коротковолновым (266 нм) электромагнитным излучением.
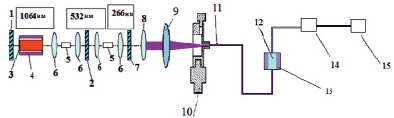
Рис. 1. Схема экспериментальной установки для регистрации спектров фотолюминесценции: 1, 2, 7 – зеркала; 3 – активный элемент; 4 – «светодиоды накачки»; 5 – нелинейный кристалл; 6, 8, 9 – линзы; 10 – держатель световода; 11 – световод; 12 – исследуемое вещество; 13 – цилиндрическая кювета диаметром 1 мм; 14 – миниспектрометр FSD-8; 15 – компьютер
Для возбуждения и регистрации спектров фотолюминесценции использовалась волоконно-оптическая методика [3, 4]. Принципиальная схема экспериментальной установки приведена на рис. 1.
В качестве источника возбуждающего ультрафиолетового излучения использовалась четвёртая гармоника (266 нм) лазера на алюмоиттриевом гранате, генерирующего импульсно-периодическое излучение с длиной волны 1064 нм, со средней мощностью генерации 10 мВт, с частотой следования импульсов 3000 Гц при их длительности 10 нс. Пиковая плотность мощности возбуждающего ультрафиолетового излучения на поверхности анализируемого препарата составляла 105 Вт/см2. Небольшое количество анализируемого вещества (12, рис. 1) в виде таблетки или жидкости помещалось в кювету (13, рис. 1). Кварцевый световод (11, рис. 1) использовался для подведения ультрафиолетового излучения к веществу и для отведения, возникающего в анализируемой пробе флуоресцентного излучения к малогабаритному спектрографу (14, рис. 1) типа FSD-8. При этом пространственное разрешение на поверхности анализируемой пробы составляло 0,1 мм. Используемый тип малогабаритного спектрографа позволял осуществлять регистрацию спектров фотолюминесценции исследуемых веществ в диапазоне 200 – 1000 нм при экспозициях 0,01-0,1 с. От миниспектрометра FSD-8 цифровая информация о спектре фотолюминесценции излучения передавалась на компьютер. После компьютерной обработки нами были построены нормированные спектры фотолюминесценции фармацевтических препаратов.
Результаты исследования и их обсуждение
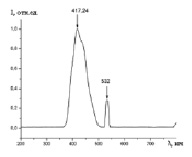
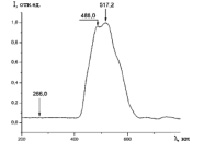
Нами были зарегистрированы спектры фотолюминесценции следующих фармацевтических препаратов: цитрамона, анальгина, аспирина и парацетамола. Рис. 2 иллюстрирует вид спектров фотолюминесценции таблетки цитрамона от нескольких точек на поверхности образца, отстоящих друг от друга на расстоянии 3-4 мм. Как видно из этого рисунка, молекулярный состав анализируемой таблетки цитрамона оказывается различным для областей поверхности, расположенных на расстоянии несколько миллиметров друг от друга. Это свидетельствует о неоднородности молекулярного состава анализируемой пробы.
Рис. 2. Вид спектров фотолюминесценции таблетки цитрамона от нескольких участков (кривые 1-3)
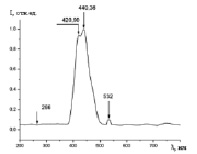
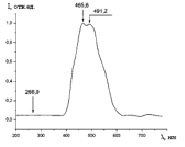
На рис. 3 (а)-(г) приводятся нормированные спектры фотолюминесценции аспирина (a), цитрамона (б), анальгина (в) и парацетамола (г). Нами также были исследованы спектры фотолюминесценции вышеприведенных всех четырёх видов препаратов различных производителей.
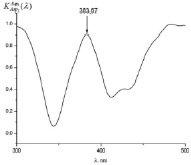
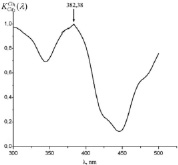
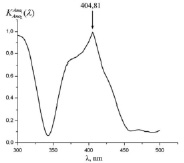
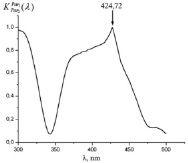
Как видно из рис. 3 (а)-(г), для всех анализируемых фармацевтических препаратов наблюдаются структурированные полосы фотолюминесценции в фиолетово-красной области спектра, форма которых несущественно отличается, по крайней мере, для цитрамона и аспирина, а также для анальгина и парацетамола. Для установления количественного отличия спектров, полученных от различных фармацевтических препаратов, нами были построены корреляционные функции (см. рис. 4) с использованием следующего соотношения [5, 6]:
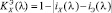 , (1)
, (1)
где iX(λ), iЭ(λ) – нормированные спектры фотолюминесценции анализируемого препарата (Х) и эталонного вещества (Э). В качестве эталонного вещества были выбраны нормированные спектры фотолюминесценции аспирина (образец № 1), цитрамона (образец № 1), анальгина (образец № 1) и парацетамола (образец № 1) и соответствующие спектры приведены на рис. 4 (а) – (г). Корреляционные спектры строились в диапазоне длин волн Δλ = 300 – 500 нм с интервалом разбиения Δλі = 0,25 нм. Кроме того, были вычислены соответствующие коэффициенты корреляции анализируемых препаратов по отношению к эталонному по формуле:
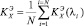 . (2)
. (2)
Все расчетные значения коэффициентов корреляции исследуемых препаратов приведены в таблице. Как видно из рис. 4 и таблицы коэффициенты корреляции исследуемых фармацевтических препаратов каждого исследуемого производителя различны. В связи с этим, предложенная нами методика позволяет идентифицировать фармацевтические препараты по производителям.
а) б)
в) г)
Рис. 3. Нормированные спектры фотолюминесценции цитрамона (a), аспирина (б), анальгина (в) и парацетамола (г)
a) б)
в) г)
Рис. 4. Корреляционные спектры анализируемых фармацевтических препаратов (а – аспирина; б – цитрамона; в – анальгина; г – парацетамола) при их сравнении со спектром флуоресценции эталона
Коэффициенты корреляции фармацевтических препаратов
|
Название вещества |
№ образца |
Коэффициент корреляции, |
|
Аспирин |
1 |
эталон |
|
2 |
0.92 |
|
|
3 |
0.90 |
|
|
Цитрамон П |
1 |
эталон |
|
2 |
0.77 |
|
|
3 |
0.76 |
|
|
4 |
0.79 |
|
|
Парацетамол |
1 |
эталон |
|
2 |
0.58 |
|
|
3 |
0.57 |
|
|
Анальгин |
1 |
эталон |
|
2 |
0.51 |
|
|
3 |
0.53 |
Вместе с тем близость вида спектров фотолюминесценции цитрамона и аспирина обусловлена присутствием в них одного и того же компонента. В то же время различия в спектрах фотолюминесценции от различных областей поверхности цитрамона (см. рис. 2) обусловлена неравномерным распределением в нём компонентов (кофеина и фенацетина). Уширение полосы фотолюминесценции анальгина по сравнению со спектром парацетамола можно объяснить более сложной молекулярной структурой анальгина.
Заключение
Таким образом, в данной работе на примере близких по структуре фармацевтических препаратов (цитрамона, аспирина, анальгина и парацетамола) показано, что для количественного неразрушающего контроля молекулярного состава и структуры биоактивных препаратов, содержащих ароматические кольца, может быть эффективно использован метод фотолюминесцентного анализа, дополненный построением соответствующих корреляционных функций, и вычислены коэффициенты корреляции. Предлагаемый метод позволяет идентифицировать фармацевтические препараты по производителям. Возбуждение спектров фотолюминесценции осуществлялось четвёртой гармоникой лазера на алюмоиттриевом гранате с использованием волоконно-оптического зонда и малогабаритного светосильного спектрографа. Разработанная методика обеспечивает получение информации от небольшого количества анализируемой пробы с высоким пространственным разрешением по поверхности образца 0,1 мм при времени экспозиции, равном 0,01-0,1 с.