Гуанидин, благодаря резонансной делокализации заряда, является сильным основанием (рКа = 13,5), сравнимым по силе с гидроксидом натрия.
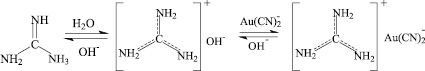
Поэтому водонерастворимые производные гуанидина применяются в качестве анионообменников [1] в том числе в щелочных растворах. Величина рКа гуанидинов зависит от природы заместителя у атомов азота. Так, если рКа изопропилгуанидина составляет 13,3, то рКа фенилгуанидина снижается до 10,8, а рКа дифенилгуанидина в растворе ДМФА составляет всего 9,14 [2].
Установлено, что, несмотря на снижение величины рКа сорбенты с гуанидиновой функцией эффективно извлекают комплексные цианиды золота. Однако возникают трудности в элюировании цианидных комплексов золота. При использовании водных щелочных растворов десорбция практически отсутствует. Эти трудности удаётся избежать, применяя для элюирования водно-органические растворы, например 0,5 моль/л раствор щелочи и бензоата натрия при повышенной температуре. В этом случае полнота элюирования металла с анионита с фенильным заместителем в гуанидиновом фрагменте достигает 96-97 %. Из сорбента с незамещенной гуанидиновой функцией в этих условиях удается десорбировать 91 % золота [1]. Надо отметить, что проведение десорбции при комнатной температуре приводит к значительно более низкому результату.
Материалы и методы исследования
Количественные спектры ЯМР 13С водных растворов гуанидинов записаны с использованием методики обратной прерываемой развязки от протонов. Записывали спады не намагниченности после 300-импульса (4,24 мс) и релаксационной задержкой между накоплениями 5 с. Мощность развязки откалибрована на 10 % растворе этилбензола в CDCl3 до получения стехиометрического соотношения интегральных интенсивностей пиков. Спектры получены накоплением 256 спадов (8000 для растворов дифенилгуанидина). Химические сдвиги определяли от внешнего стандарта (D2O) без поправок на температурную восприимчивость. Спектры регистрировали на приборе ЯMP спектрометре «Bruker Avance» III 600.
Химсдвиги ЯМР 13С гуанидинов в водных кислых и щелочных средах
|
Концентрации реагентов моль/л в водной и водно-органической фазе |
Химический сдвиг в мд С13 |
Свободное основание % |
|
|
протонированной формы |
свободного основания |
||
|
Гуанидин + 0,01 HCl |
158.1 |
00 |
|
|
Гуанидин +0,1 NaOH |
158,5 |
168,1 |
36 |
|
Гуанидин +0,5 NaOH |
159,3 |
168,0 |
45 |
|
Гуанидин +0,5 NaOH + 0,5 NaClO4 |
159,0 |
168,0 |
26 |
|
Гуаниди +2 NaOH |
160,7 |
168,1 |
74 |
|
Гуанидин +0,5 NaOH + 0,5 бензоат натрия |
159,5 |
168,0 |
37 |
|
N1,N3-Дифенилгуанидин + 0,5 CF3CO2H |
155,3 |
00 |
|
|
N1N3-Ди-изопропилгуанидин + 0,5 CF3CO2H |
157,0 |
00 |
|
|
N1N3-Дифенилгуанидин + 0,5NaOH +50 % ацетон |
159,0 |
168,4 |
20 |
|
N1N3-Ди-изопропилгуанидин + 0,5 NaOH |
168,0 |
100 |
|
В эксперименте использовали реактивы марки х.ч. Концентрация гуанидинов в растворах 0,01 моль/л. Для исключения повторного протонирования гуанидинов применяли разбавленные кислоты.
Результаты исследования и их обсуждение
Недостаточная полнота элюации золота и других металлов при использовании только водных щелочных растворов, по-видимому, обусловлена присутствием на поверхности сорбента протонированной формы гуанидина, которая прочно удерживает анион. Для подтверждения этой гипотезы исследованы методом ЯМР 13С водные растворы некоторых гуанидинов с различными значениями рКа. В таблице приведены химсдвиги протонированных и непротонированных форм гуанидинов и их соотношение.
В кислой среде незамещенный гуанидин полностью протонирован, химсдвиг сигнала протонированной формы 158,1 мд. Отметим, что в суперкислоте возможно как моно-, так и ди-, три-, и тетрапротонирование гуанидина [3, 4]. При растворении гуанидин карбоната в воде водная фаза становится щелочной, рН достигает величины 11,6. В спектре ЯМР кроме сигнала 158,1 мд появляется дополнительно сигнал свободного основания при 167,5 мд. При содержании щелочи в воде до 0,5 моль/л. протонированная форма в растворе преобладает. Даже в присутствии 2 моль/л щелочи около 25 % гуанидина находится в протонированной форме. Этот факт объясняет причину, почему из сильноосновных ионообменников затруднена элюация золота растворами щелочей.
Ясно, что при связывании катиона гуанидиния например цианидом золота или анионом перхлората натрия образуется прочная слабо диссоциирующая соль и количество протонированной формы должно соответствовать содержанию соли. Действительно, в присутствии перхлората содержание катиона гуанидиния в 0,5 моль/л растворе щелочи возрастает с 55 до 74 %.
Судя по положению сигналов в спектрах растворов 0,5 моль/л СF3CO2H как N1,N3-дифенил-, так и N1,N3-ди-изопропилгуанидин находятся в протонированной форме и регистрируются при 155,3 и 157 м.д. соотетственно. В щелочном растворе N1,N3-ди-изопропилгуанидин переходит полностью в свободное основание, сигнал ЯМР 13С которого находится при 168 мд. Поскольку N1,N3-дифенилгуанидин в 0,5 моль/л водной щелочи растворим крайне ограничено, спектр ЯМР 13С для него записан в смеси с ацетоном. Наличие двух сигналов при 159,0 и 168,4 мд указывает на присутствие в смешанном растворителе, как свободного основания 20 %, так и протонированной формы.
Из эксперимента следует, что для эффективной сорбции золота и свободного его элюирования следует подбирать сорбент, у которого константа кислотности рКа находится на уровне 9÷11.
Отметим, что применение смешанного водно-органического элюента на основе 0,5 моль/л щелочи и бензоата натрия для извлечения золота, очевидно, вызвано не смещением равновесия в сторону свободного основания (таблица), а влиянием изменения диэлектрической проницаемости раствора.
Выводы
Методом ЯМР 13С установлено существование равновесия в водных растворах между протонированной формой гуанидинов и свободными основаниями. В кислых растворах гуанидины полностью протонированы. В основной среде присутствуют обе формы, так для незамещенного гуанидина протонированная форма сохраняется даже в 2 молярном растворе щелочи. Этот факт объясняет необратимость сорбции цианида золота сильноосновными смолами с гуанидиновой функцией.

