Возрастающий интерес к созданию новых производных 5-деазафлавина-пиримидо [4,5-b]хинолин-2,4(3H,10H)диона обусловлен тем, что они признаны как новый класс таргетно действующих противоопухолевых агентов, обладающих широким спектром ингибирующей активности в отношении ряда опухолевых штаммов [4, 6]. Продолжая ранее начатые исследования по изысканию новых эффективных противоопухолевых средств среди производных 5-деазафлавина и бензо[b]пиримидо[5,4-g[1,8] нафтиридина[1,2] в настоящей работе осуществлен синтез ряда новых производных названных гетероцикли- ческих систем, изучены их противоопухолевые свойства и воздействие на уровень метилирования опухолевой ДНК. Синтез проведен по схеме (рисунок).
С целью уточнения роли заместителя в положении 10 на биологическую активность 9-метокси-5-деазафлавина в качестве исходных соединений были выбраны различные 6-алкил-, фенил-, бензиламинозамещенные урацилы 1а-е, полученные обработкой 6-хлорурацила соответствующими алкил- или ариламинами [1,4,6]. Циклоконденсация последних с 2,3-диметоксибензальдегидом по разработанному нами методу привела к намеченным 5-деазафлавинам 3а-е [1,2]. Реакцией аннелирования тех же 6-аминозамещенных урацилов 1а-е 2-хлор-7-метил(или метокси)хинолин-3-карбальдегидами, синтезированными методом Вильсмеера [8], получены 12-или 9,12-замещенные бензо[b]пиримидо[5,4-g[1,8]нафтиридин-2,4-дионы 5а-е. Последние представляют интерес в качестве структурной основы многих биологически активных соединений [6,7]. Гетероциклизация протекает при кипяченни 6-аминозамещенных урацилов 1а-е с альдегидами 4а-с в ДМФА в течение 8-10 ч.
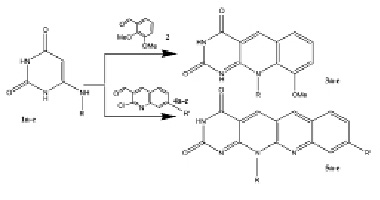
1,3a-e, R=Me(a), (CH2)3 OH(b), Ph(c), C6H3-2-OH-5-CH3(d),Bn(e). 4a-c, =H(a), R’=CH3(b), R’=ОCH3(с). 5a-e, R=(CH2)3OH,R’=H(a); R=Bn, R’=H(b); R=Me, R’=9-Ме(с); R=(CH2)3OH, R’=9-Me(d); R=Ph, R’=9-OMe (e)
Чистота и строение синтезированных соединений подтверждены методами ТСХ, ЯМР1Н и элементным анализом.
Экспериментальная химическая часть
Спектры ЯМР 1H регистрировали на спектрометре Varian Mercury-300VX с рабочей частотой 300 МГц, внутренний стандарт – ТМС. Температуры плавления определяли на микронагревательном столике «Boetius 72/2064». Ход реакций контролировали методом ТСХ на пластинках Silufol UV-254 в системах хлороформ–этанол, 4:1 или диоксан–бензол, 3:1, проявление УФ облучением.
9-Метокси-10-замещенные 5-деазафлавины 3а-е описаны нами в работе [2].
Тетрагидробензо[b]пиримидо[5,4-g][1,8]нафтиридин-2,4-дионы(5а-е). Общая методика. Смесь 1ммоль соответствующего урацила 1а-е, 1ммоль 2-хлорхинолин-3- или 2-хлор-7-метил(метокси)хинолин-3-карбальдегида 4 в 20 мл ДМФА кипятят 8-10 ч. Конец реакции контролируют методом ТСХ. Отгоняют растворитель, твердый остаток дважды промывают метанолом, затем диэтиловым эфиром и сушат на воздухе.
12-(3-Гидроксипропил)-2,3,4,12-тетрагидробензо[b]пиримидо[5,4-g][1,8]нафти- ридин-2,4-дион(5а). Выход 47 %, т.пл. > 360 °С. Спектр ЯМР1H, б, м.д.: 1.95-2.05 м (2Н, CH2), 3.58 тд. (2Н,CH2ОН,J1, 6.4, J2 5.2 Гц), 4.58 т (1Н, ОН, J 5.2 Гц), 4.91 т (2Н, NCH2, J 7.0 гц), 7.65 дд (1Наром., J1 9.0, J2 2.4 Гц), 7.95-8.21 м (3Наром.), 9.03 с (1Н,=СН), 9.15 с (1Н, =СН), 11.21 уш.с (1Н, NH). Найдено, %: С 63.57; Н 4.62; N 17.38. C17 H14 N4 O3. Вычислено, %: C 63.34; H 4.37; N 17.38.
12-Бензил-2,3,4,12-тетрагидробензо[b]пиримидо[5,4-g][1,8]нафтиридин-2,4-дион (5b). Выход 52 %, т.пл. 346–347 °С. Спектр ЯМР1H, б, м.д.: 6.08 с (2Н, NCH2), 7.21-7.48 м (5Наром.), 7.65 т (1Наром.), 7.91-8.08 м (2Наром), 8.18 д (1Наром., J 9.1 Гц), 9.07 с (1Н,=СН), 9.24 с (1Н,=СН), 11.27 уш.с (1Н, NH). Найдено, %: С 71.33; Н 3.64; N 15.53. C21 H14 N4 O2. Вычислено, %: C 71.17; H 3.98; N 15.81.
9,12-Диметил-2,3,4,12-тетрагидробензо[b]пиримидо[5,4-g][1,8]нафтиридин-2,4-дион (5с). Выход 71 %, т.пл. 343–345 °С. Спектр ЯМР1H, б, м.д.: 2.59 с (3Н, CH3), 4.03 с (3Н, NCH3), 7.42 дд (1Наром., J1 9.1,J2 2.4 Гц), 7.80-8.29 м (2Наром.), 9.02 с (1Н, =СН), 9.21 с (1Н, =СН). ). Найдено, %: С 65.47; Н 7.39; N 19.02. C16 H12 N4 O2. Вычислено, %: C 65.74; H 7.58; N 19.16.
9-Метил-12-(3-гидроксипропил)-2,3,4,12-тетрагидробензо[b]пиримидо[5,4-g] [1,8]нафтиридин-2,4-дион (5d). Выход 63 %, т.пл > 360 °С. Спектр ЯМР1H, б, м.д.: 1.92-2.03 м (2Н, CH2), 2.59 с (3Н, CH3), 3.55 тд (2Н, CH2ОН, J1 6.4, J2 5.2 Гц), 4.61 т (1Наром., J1 9.0,J2 2.4 Гц), 4.91 т (2Н, NСН2,J 7.0 гц), 7.51 дд (1Наром., J1 9.0,J2 2.4 гц), 7.85 д (1Наром., J2.4 гц), 8.09 д (1Наром., J 9.0 Гц), 9.02 c (1Н, =СН), 9.18 с (1Н, =СН), 11.21 уш.с. (1Н, NН). Найдено, %: С 64.35; Н 5.41; N 16.37. C18H16N4O3. Вычислено, %: C 64.08; H 5.07; N 16.60.
9-Метокси-12-фенил-2,3,4,12-тетрагидробензо[b]пиримидо[5,4-g][1,8]нафтири-дин-2,4-дион (5е). Выход 65 %, т.пл > 300 °С. Спектр ЯМР1H, б, м.д.: 3.90 с (3Н, ОСН3), 6.89 д (1Наром., J 2.0 Гц), 7.25 дд (1Наром., J1 9.0,J2 2.0 Гц), 7.32-7.65 м (5Наром), 8.09 д (1Наром., J 9.0 Гц), 9.09 с (1Н, =СН), 9.15 с (1Н, =СН), 11.17 с (1Н, NН). Найдено, %: С 68.35; Н 3.57; N 15.32. C21 H14 N4 O3. Вычислено, %: C 68.10; H 3.81; N 15.13.
Экспериментальная биологическая часть
Уровень метилирования ДНК определяли на модели перевиваемой опухоли мышей саркоме 180, извлеченной после забоя животных методом передозировки эфирного наркоза. К опухолевому гомогенату добавляли 3х10-6 М раствора исследуемых веществ (на 10г опухоли 12,5мл раствора). В качестве растворителя использовали 0,5 % раствор карбоксиметилцеллюлозы (КМЦ). После инкубации в термостате при 37оС, в течение 24 ч экстрагировали ДНК фенольно-хлороформенным методом [9], затем осуществляли кислотный гидролиз ДНК до азотистых оснований: гуанин (Г), цитозин (Ц), 5-метилцитозин (5МЦ), аденин (А), тимин (Т). С помощью тонкослойной хроматографии в растворителе н-бутанол:вода:аммиак (60:10:0,1) проводили спектрофотометрию элюатов всех оснований.
Противоопухолевую активность 9-метокси-10-замещенных 5-деазафлавинов 3а-е и бензопиримидонафтиридинов 5а-е изучали на модели саркома 180 согласно [3]. Соединения вводили животным в виде взвеси в КМЦ в дозе 125 мг/кг, спустя 48 ч после перевивки опухоли, внутрибрюшинно, ежедневно, в течение 6 дней. Контрольные животные в те же сроки эксперимента получали эквивалентный объем растворителя (КМЦ). Через 24 ч после последней инъекции животных забивали, определяли процент торможения роста опухоли по отношению к контролю, согласно общеизвестной формуле [3]. В опытах использовали 70 белых беспородных мышей обоего пола с исходным весом 20-24 г.
Полученные данные обрабатывали статистически согласно методу Стъюдента-Фишера.
Опухолевая ДНК, выделенная в ходе эксперимента, принадлежит к АТ-типу. Количество (Г+Ц+МЦ) в них составляет 41,7-44,2 моль %. Нуклеотидный состав ДНК соответствует правилам Чаргаффа.
Согласно полученным данным, четкое различие между образцами ДНК из опухолевой ткани после воздействия соединений 3а-e и 5a-e обнаруживается только в отношении содержания 5-МЦ. Из приведенных в таблице данных следует, что большинство изученных веществ вызывает заметное ингибирования уровня метилирования опухолевой ДНК. При этом наибольшим деметилирующим действием среди 5-деазафлавинов 3а-е обладали производные, содержащие гидроксипропил-, бензил-, 2,4-замещенный фенил- и фенил- фрагменты в структуре (3b, 3е, 3d, 3с). Они угнетали метилирование ДНК соответственно на 63,3; 58,3; 49,2 и 41,7 % (P < 0,05). Среди бензопиримидонафтиридинов 5а-е относительно эффективными оказались 3-гидроксипропил- и 9,12-диметилзамещенные аналоги 5а и 5с, которые ингибировали уровень метилирования ДНК соответственно на 50,8 и 45,8 % (P < 0,05). Деметилирующая способность соединений может быть обусловлена их влиянием на аномально метилированные гены, приводящие к торможению роста опухоли [5].
Нуклеотидный состав опухолевой ДНК
|
Соединение |
Содержание оснований в ДНК, мол. % |
Угнетение уровня метилирования, % |
|||||
|
Г |
Ц |
5-МЦ ± ς |
А |
Т |
Г+Ц+5-МЦ |
||
|
Саркома 180 |
21,81 |
20,61 |
1,20 ± 0,03 |
28,19 |
28,19 |
43,62 |
|
|
3а |
20,85 |
19,85 |
1,00 ± 0,02 P < 0,05 |
29,15 |
29,15 |
41,7 |
- |
|
3b |
21,98 |
21,54 |
0,44 ± 0,02 P < 0,05 |
28,02 |
28,02 |
43,96 |
63,3 |
|
3с |
21,15 |
20,45 |
0,70 ± 0,04 P < 0,05 |
28,85 |
28,85 |
42,3 |
41,7 |
|
3d |
21,31 |
20,70 |
0,61 ± 0,03 P < 0,05 |
28,69 |
28,69 |
42,62 |
49,2 |
|
3е |
21,47 |
20,97 |
0,50 ± 0,05 P < 0,05 |
28,53 |
28,53 |
42,94 |
58,3 |
|
5а |
22,06 |
21,47 |
0,59 ± 0,04 P < 0,05 |
27,94 |
27,94 |
44,12 |
50,8 |
|
5b |
21,58 |
20,56 |
1,02 ± 0,05 P < 0,05 |
28,43 |
28,43 |
43,16 |
15 |
|
5с |
21,59 |
20,94 |
0,65 ± 0,01 P < 0,05 |
28,41 |
28,41 |
43,18 |
45,8 |
|
5d |
21,61 |
20,75 |
0,86 ± 0,02 P < 0,05 |
28,39 |
28,39 |
43,22 |
28,3 |
|
5е |
21,99 |
20,89 |
1,10 ± 0,02 P < 0,05 |
28,01 |
28,01 |
43,98 |
- |
В химиотерапевтических экспериментах некоторые производные 5-деазафлавина 5а-е и бензопиримидонафтиридина 5а-е проявили слабую или умеренную противоопухолевую активность в отношении саркомы 180, угнетая ее рост на 32-50 % (P < 0,05). При сравнительной оценке полученных результатов установлена некоторая корреляция между in vitro и in vivo данными. Так, 3-гидроксипропилзамещенный аналог 5-деазафлавина (3b), обладающий выраженным деметилирующим действием в опытах in vitro (63,3 %), в in vivo условиях также проявляет наибольшую противоопухолевую активность (ингибирование роста саркомы 180 на 50 %, P < 0,05). Аналогичным образом соединение 3е с относительно меньшим деметилирующим действием (58,3 %), обладало слабой терапевтической активностью (торможение роста опухоли на 30,5 %, P < 0,05). В отличие от прозводных 5-деазафлавина аналоги бензопиримидонафтиридинов с умеренными деметилирующими свойствами (5а и 5с) в химиотерапевтических опытах не проявили достоверное противоопухолевое действие.
Выводы
На основе полученных результатов можно сделать следующие выводы:
Осуществлен синтези новых 9,12-замещенных бензо[b]пиримидо[5,4-g][1,8]нафтиридин-2,4-дионов. Изучением протовоопухолевых свойств описанных соединений и их воздействия на уровень метилирования опухолевой ДНК в условиях in vitro показано, что большинство из них проявляют значительное ингибирование уровня метилирования опухолевой ДНК и слабую или умеренную противоопухолевую активность. Установлена корреляция методу in vitro и in vivo данными, что указывает на перспективность поиска более эффективных соединений в этих рядах.

