Гипертоническая болезнь относится к самым часто встречающимся патологиям сердечно – сосудистой системы и распространена во всем мире, особенно в цивилизованных странах. Имеются данные о том, что в патогенезе первичной гипертензии ведущая роль принадлежит мембранным нарушениям [7].
Классической моделью для изучения свойств мембраны при различной патологии служит мембрана эритроцита. Его цитоплазматическая мембрана является ключевой в обеспечении и регуляции физиологической активности этих клеток. Специфические функции мембраны обеспечиваются её сложной структурной организацией, главными компонентами которой являются белки. Наиболее представительными белками в мембране эритроцитов человека являются спектрины, анионтранспортный белок полосы 3, а также сократительные белки – актин и тропомиозин. И, хотя мембраносвязанный гемоглобин (МСГ) представлен в меньшем количестве, чем остальные белки, он играет важную роль как в образовании и поддержании стабильности цитоскелета, так и в механизмах ферментативного катализа и внутриклеточной трансформации энергии [2].
В ряде работ отмечено высокое содержание МСГ у больных ИБС III-го функционального класса, язвой желудка или 12-ти перстной кишки, на лактатной модели гипоксического состояния [3], при остром отравлении монооксидом углерода [8], нитрита натрия и солянокислого фенилгидразина [10]. В наших работах также было выявлено повышение уровня МСГ у больных ИБС и ГБ, что указывало на деструктивные процессы в мембране эритроцитов [5]. Установлено, что образование избыточных ковалентных связей гемоглобина с мембранным скелетом, разрушает её белковую структуру и способствует окислению фосфолипидов через Са2+-зависимую липооксигеназную активность [10]. Кроме того, автор показал, что изменение взаимодействия мембраны эритроцита с гемоглобином может быть обусловлено повышенным содержанием в ней фосфатидилсерина и сфигномиелина, а также структурным состоянием самого гемоглобина. В монографии Ю.В. Постнова и С.Н. Орлова [7] показано, что нарушения структурной организации плазматической мембраны при первичной гипертензии вызваны изменениями в белках, образующих её цитоскелет. Тем не менее мы не нашли сообщений о влиянии МСГ на отдельные белки мембраны эритроцитов при сердечно – сосудистой патологии.
Целью нашей работы явилась оценка воздействия разных уровней мембраносвязанного гемоглобина на величину белков мембраны эритроцитов и их взаимосвязь у больных гипертонической болезнью.
Материалы и методы исследования
В исследовании принимали участие пациенты с гипертонической болезнью (ГБ) I и II степени (n = 51) в возрасте 42 ± 1,5 лет, мужского пола. Диагноз ГБ, а также дифференциальную диагностику для исключения симптоматических артериальных гипертоний проводили в соответствии с рекомендациями ВНОК (2008). Критериями исключения для больных являлись наличие острого инфарта миокарда или нарушения мозгового кровообращения в предшествующие 6 месяцев, нарушения ритма сердца, наличие приступов стенокардии напряжения, обострение интеркурентных заболеваний.
В контрольную группу входили клинически здоровые мужчины в количестве 29 человек, средний возраст которых составил 39 ± 1,3 лет. Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинской декларации. Все пациенты были ознакомлены с целями и основными положениями исследования. До включения в исследование у всех участников было получено письменное информированное согласие.
У всех пациентов определяли основные белки мембраны эритроцитов, мембраносвязанный гемоглобин. Определение МСГ в структурных фрагментах мембраны эритроцитов проводили в гемолизате по убыли гемоглобина до и после центрифугирования при 6000 об/мин на спектрофотометре СФ-2000 при длине волны 536 нм по методике З.С. Токтамысовой и Р.Х. Биржановой [9].
Мембраны эритроцитов выделяли по методу Dodge [11]. Выделение и очистку водорастворимой фракции белков осуществляли на центрифугах «Allegra» 64R. Концентрацию белков определяли с использованием набора Qubit Protein Assay Kit («Invitrogen», США) на приборе Gubit Protein, согласно инструкции фирмы – изготовителя.
Одномерный электрофорез проводился на полиакриламидных гелевых пластинах с концентрацией разделяющего геля 7,5 % и 15 % в присутствии додецилсульфата натрия по методу Лэммли [12]. Окраска гелевых пластинок проводилась раствором Кумасси R250 («Sigma», США). Для определения массы исследуемых белков использовались наборы маркеров фирмы Bio-Rad (#161-0363) и Thermoscientific (#26614). Расчет количественного содержания мембранных белков (мкг на 1мг общего белка) выполнялся с помощью программы математической обработки электофореграмм [6].
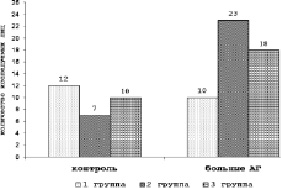
Рис. 1. Распределение лиц контрольной группы и больных АГ по уровню мембраносвязанного гемоглобина. Примечание. *p < 0,05 – значимость различий между соответствующими группами контроля и больных АГ; **p < 0,05 – между 1-ой и остальными группами больных АГ, точный критерий Фишера
Данные к рис. 1
|
контроль |
больные АГ |
|
|
1 группа |
12 |
10 |
|
2 группа |
7 |
23 |
|
3 группа |
10 |
18 |
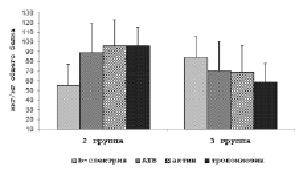
Рис. 2. Количественное содержание белков мембраны эритроцитов у больных АГ с разным уровнем мембраносвязанного гемоглобина. Примечание. Me (Q25-Q75); р – критерий Манн-Уитни
Данные к рис. 2
|
2 группа |
3 группа |
|
|
β-спектрин |
55 |
83,9 |
|
АТБ |
89 |
70,3 |
|
актин |
95,9 |
69 |
|
тропомиозин |
95,8 |
58,5 |
Характер корреляционных связей между количественным содержанием белков мембраны эритроцитов у больных АГ 2-ой и 3-ей групп
|
2 группа (n = 23) |
|||||||||
|
1 |
2 |
2.1 |
3 |
4.1 |
4.5 |
5 |
6 |
7 |
|
|
2 |
0,93 |
||||||||
|
2.1 |
0,79 |
0,68 |
|||||||
|
3 |
0,63 |
0,60 |
0,55 |
||||||
|
4.1 |
0,57 |
0,48 |
0,65 |
0,92 |
|||||
|
4.5 |
0,49 |
0,53 |
0,84 |
0,93 |
|||||
|
5 |
0,62 |
0,66 |
0,73 |
||||||
|
6 |
0,52 |
0,44 |
0,56 |
0,78 |
0,80 |
0,86 |
0,56 |
||
|
7 |
0,46 |
0,57 |
0,57 |
0,57 |
0,68 |
0,44 |
|||
|
8 |
0,59 |
0,44 |
0,59 |
0,76 |
0,72 |
0,75 |
0,53 |
0,84 |
0,73 |
|
3 группа (n = 18) |
|||||||||
|
2 |
0,74 |
||||||||
|
2.1 |
0,51 |
||||||||
|
3 |
0,51 |
0,62 |
|||||||
|
4.1 |
0,48 |
0,73 |
0,83 |
||||||
|
4.5 |
0,48 |
0,80 |
0,78 |
||||||
|
5 |
0,52 |
0,59 |
0,49 |
||||||
|
6 |
0,85 |
0,74 |
0,91 |
||||||
|
7 |
-0,74 |
||||||||
|
8 |
0,57 |
0,69 |
0,68 |
0,58 |
|||||
Примечание. 1 – α-спектрин, 2 – β-спектрин, 2.1 – анкирин, 3 – АТБ, 4.1 – полоса 4.1, 4.5 – транспортёр глюкозы, 5 – актин, 6 – Г-3-ФДГ, 7 – тропомиозин, 8 – Гл.-S-Тр. Коэффициенты ранговой корреляции Спирмена – p < 0,05. Тесные связи выделены жирным шрифтом.
В результате исследования 320 электрофореграмм белкового спектра была проведена количественная оценка 10-ти мембранных белков эритроцитов: α-спектрина, β-спектрина, анкирина (полоса 2.1), анион-транспортного белка (АТБ), полосы 4.1, трансмитера глюкозы (GLUT), актина, глицеральальдегид-3-фосфатдегидрогеназы (Г-3-ФДГ), тропомиозина и глутатион-S-трансферазы (Гл.-S-Тр.).
Статистическая обработка результатов проводилась с помощью пакета программ «Statistica 6.0». Полученные данные в сравниваемых группах анализировали, используя критерий Манна-Уитни. Взаимосвязь переменных оценивали путём изучения парной ранговой корреляции (Спирмен). Различия считались достоверными при р < 0,05.
Результаты исследования и их обсуждение
При анализе уровня МСГ выяснилось, что его количество у больных АГ было значимо выше (р = 0,021), чем у лиц контрольной группы – соответственно: 9,22 (7,1-11,8) и 6,6 (5,0-9,4). Учитывая значительный разброс данных, все больные АГ и лица контрольной группы были разделены по уровню МСГ на три группы: 1-ая группа – с содержанием МСГ меньше 6 %, 2-ая группа – от 6 до 9,0 % и 3-я группа – больше 9,0 % (рис. 1).
Из представленных данных видно, что в количественном отношении превалировали больные 2-ой группы, а меньший процент составили больные 1-ой группы. Среди клинически здоровых людей существенных межгрупповых различий выявить не удалось.
Сравнительный анализ изучаемых белков мембраны эритроцитов у контрольных лиц также не выявил межгрупповых различий. Исследование белковых компонентов мембраны эритроцитов у больных АГ (рис. 2) показало, что во 2-ой группе отмечалось меньшее количество β-спектрина и большее – анионтранспортного белка, актина и тропомиозина.
Как известно, основная функция спектринов – поддержание формы клеток и обеспечение их устойчивости к деформации, а также контроль над латеральной подвижностью интегральных мембранных белков [1]. Снижение содержания β-спектрина может приводить к потере эластичности мембраны, уменьшению деформабильных свойств и ухудшению прохождении эритроцитов через обменные капилляры. Большее содержание анионтранспортного белка (АТБ) у больных 2 группы, вероятно, оказывает регулирующее и координирующее влияние на метаболические процессы и структурное состояние мембраны так, как по своей природе он является полифункциональным и действует как сайт связывания мембранных белков. Иная картина наблюдалась при высоком уровне МСГ (3 группа): здесь отмечалось возрастание содержание β-спектрина, резкое снижение содержания АТБ, актина и тропомиозина, что говорит о повреждении цитоскелета мембраны у этой категории больных. Кроме того, снижение содержания тропомиозина приводит к еще большему изменению формы эритроцитов вплоть до образования эхиноцитов и сфероцитов, от которых отшнуровываются мелкие мембранные везикулы [7], содержащие тканевой фактор активации внешней системы свёртывания крови [4].
Корреляционный анализ межбелковых связей в мембране эритроцита показал, что количество и уровень этих связей у больных ГБ 2-ой и 3-ей групп значительно различались между собой. Так у больных 3-ей группы был существенно меньше уровень и количество межбелковых связей, чем во 2-ой группе Это касалось α-спектрина, анкирина, АТБ, полосы 4.1, транспорта глюкозы, актина и особенно тропомиозина (таблица).
Нужно отметить, что белкам полосы 2.1 (анкирин) и 4.1 также отводится ключевая роль в образовании цитоскелета мембраны. Оба белка обладают высокой чувствительностью к протеазам, легко фосфорилируются и связываются со спектринами. Именно изменения взаимодействия между спектринами, анкирином и фосфолипидами нарушают условия для поддержания в нормальном состоянии участки липидного бислоя мембраны и способствуют процессу экзоцитоза, приводящего к образованию мембранных везикул [7].
Таким образом, проведённые исследования показали, что высокий уровень мембраносвязанного гемоглобина оказывает существенное влияние на структурные, интегральные (β-спектрин, АТБ) и сократительные (актин, тропомиозин) белки мембраны эритроцитов. В результате количественного изменения этих белков мембраны и их взаимосвязей у больных гипертонической болезнью возникают нарушения структурной организации и функциональной активности мембраны, снижаются буферные свойства эритроцитов, нарушаются реологические и гемостазиологические характеристики крови. Такое состояние, несомненно, ухудшает перфузию крови в микроциркуляторном русле, тканевой газообмен и, тем самым, усиливает системную гипоксию, которая имеет место при данной патологии.

