Одной из проблем сохранения репродуктивного здоровья нации является увеличение частоты воспалительных заболеваний, ассоциированных с условно-патогенной микрофлорой (УПМ) и увеличение спектра этиологически значимых микроорганизмов из состава резидентной микробиоты урогенитального тракта (УГТ) при одновременном снижении заболеваемости инфекциями, передающимися половым путем (ИППП). Следствием нарушения микробиоценоза УГТ является увеличение риска развития воспалительных заболеваний органов малого таза (ВЗОМТ), осложнения течения беременности и родов, снижение качества жизни, формирование резистентных штаммов бактерий [1, 2, 3, 4, 5, 7, 10]. Одним из триггерных факторов формирования бактериального вагиноза является, в том числе, и наличие некоторых видов лактобактерий (L. iners) [6]. Половые партнеры пациенток с хроническими воспалительными заболеваниями УГТ, обусловленными условно-патогенной микрофлорой, достоверно чаще страдают эректильной дисфункцией, простатитами, нарушением фертильности [9]. Условно-патогенные микроорганизмы при наличии у пациента клинико-лабораторных признаков уретрита, выделяются в диагностических титрах в три раза чаще, чем облигатные патогены и проявляют высокую резистентность к антибактериальным препаратам [8].
Активно развивающимся направлением молекулярной биологии является матричная лазерная десорбционная времяпролетная масс-спектрометрия (MALDI-TOF-MS) – протеомный анализ, метод идентификации молекул путем измерения отношения их массы к заряду в ионизированном состоянии. Использование прямой МАЛДИ масс-спектрометрии для идентификации и типирования микроорганизмов возможно благодаря регистрации уникальных белковых масс-спектров, воспроизводимых для семейств, родов, видов и подвидов микроорганизмов, с чувствительность 105-106 клеток и 100 % специфичностью. В связи с тем, что наличие условно-патогенной микрофлоры в урогенитальном тракте не является доказательством ее этиологической роли в формировании воспаления, только учет количественных соотношений отдельных видов микроорганизмов может характеризовать состояние вагинального микроценоза и степень его нарушения.
Цель исследования
Оценить возможности протеомного анализа для видовой идентификации условно-патогенных микроорганизмов методом масс-спектрометрического профилирования бактерий у пациенток репродуктивного возраста с воспалительным процессом урогенитального тракта.
Материалы и методы исследования
С целью изучения качественного и количественного состава факультативно-анаэробной и микроаэрофильной микробиоты влагалища проведено комплексное клинико-лабораторное обследование 378 пациенток репродуктивного возраста (18 – 45 лет) (средний возраст 31,4 ± 0,5 года) с жалобами на гнойные или слизисто-гнойные выделения, дискомфорт и/или зуд наружных половых органов, диспареунию, с наличием признаков воспаления во влагалище, которое включало идентификацию микробиоты методом масс-спектрометрического профилирования бактерий и исключение облигатных возбудителей ИППП. Критерии включения: возраст 18-45 лет; наличие подписанного информированного добровольного согласия на участие в исследовании; диагноз вагинит, подтвержденный микроскопическим и микробиологическим методами, объективной клинической картиной. Критерии исключения: возраст моложе 18 и старше 45 лет, наличие ИППП (положительные результаты лабораторных тестов на наличие N. gonorrhoeae, C. trachomatis, T. vaginalis, M. genitalium, вируса простого герпеса (HSV), вируса папилломы человека (HPV), сифилиса, ВИЧ, предшествующая антибактериальная терапия в течение последних 3 месяца до исследования, невозможность посещения клиники. Подготовка материала для оценки урогенитальной микрофлоры выполнялась в соответствии с приказом МЗ СССР № 535 от 22.04.1985 г. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Первичный посев с полуколичественной оценкой роста микроорганизмов проводили на селективные и дифференциально-диагностические питательные среды: 5 % кровяной агар, агар MRS для лактобактерий и агар Сабуро для грибов. Степень микробной обсемененности определяли в пересчете на тампон – КОЕ/т. Все посевы культивировали по стандартной методике при температуре 36 °С в течение 24–48 часов. Культивирование микроаэрофилов осуществляли в СО2 инкубаторе при 5 % концентрации углекислого газа.
Идентификация выделенных культур микроорганизмов проводилась на анализаторе VITEK MS (BioMerieux, Франция) методом MALDI – TOF (матричная лазерная время-пролетная масс-спектрометрия). Экстракция белков осуществлялась на одноразовом слайде с использованием готового матрикса для VITEK MS. Интерпретация результатов проводилась с использованием базы данных VITEK MS, состоящей из клинически значимых видов и расширенного классификатора спектров.
Для выявления представителей семейства Mycoplasmataceae использовались наборы «Mycofast Evolution 3» (ELITech Microbio, Франция) с определением чувствительности к антимикробным препаратам.
Результаты исследования и их обсуждение
Основными представителями микробиоты влагалища были: лактобактерии (69,3 %), дрожжеподобные грибы рода Candida (19,0 %), представители семейства Enterobacteriaceae (18,9 %), бактерии рода Staphylococcus (18,5 %), Streptococcus (12,7 %), Enterococcus (10,1 %), а также G. vaginalis (13,8 %), грамположительные палочки рода Corynebacterium (3,4 %), грамотрицательные палочки рода Haemophilus (0,5 %), Ureaplasma spp. были обнаружены у 9,3 % пациенток, Mycoplasma hominis– 3,6 %, ассоциации Ureaplasma spp. и Mycoplasma hominis – 3,8 % (рис. 1).
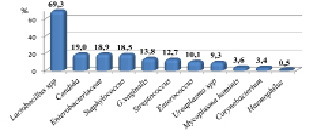
Рис. 1. Факультативно-анаэробная и микроаэрофильная микробиота урогенитального тракта пациенток репродуктивного возраста (n = 378)
Микроскопия нативных мазков выявила воспалительную реакцию слизистой оболочки влагалища у 72,5 % пациенток:10-20 лейкоцитов в поле зрения – у 19,9 %, 20 – 80 лейкоцитов – у 40,9 % и у 11,7 % более 80 лейкоцитов в поле зрения. У 27,5 % пациенток количество лейкоцитов в мазках было в пределах нормы (до 10 в поле зрения).
Полная информация о микробиоте влагалища пациенток, идентифицированной методом масс-спектрометрии представлена на рис. 2.
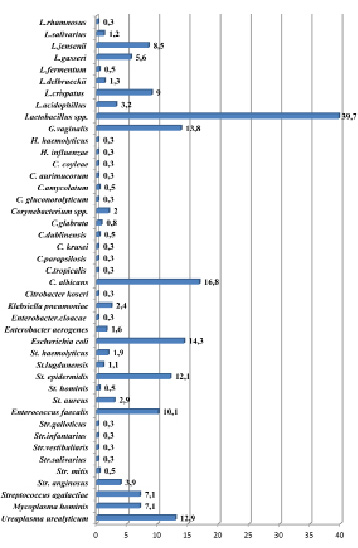
Рис. 2. Частота обнаружения резидентных и транзиторных условно-патогенных микроорганизмов у пациенток репродуктивного возраста (n = 378),* идентифицированная методом масс-спектрометрии.* Поливариантный признак
У 116 пациенток (30,7 %) отсутствовал рост культивируемых на MRS агаре лактобактерий, которые обеспечивают колонизационную резистентность влагалища и препятствуют чрезмерному размножению и транслокации условно-патогенных микроорганизмов. В 150 (39,7 %) случаев определение осуществлялось до рода (Lactobacillus spp.). Видовое белковое профилирование 112 образцов с лактобактериями (29,6 %), позволило идентифицировать следующие их виды: L. crispatus (30,4 %), L. jensenii (28,6 %), L. gasseri (19,6 %), что опровергает ранее существовавшее мнение о доминирующем положении L. acidophilus (10,7 %). В меньшей степени встречались L. delbrueckii, L. salivarius, L. fermentum, L. rhamnosus (рис. 3). У 53,8 % пациенток лактобактерии выделялись в высоких титрах (107 КОЕ/т), у 46,2 % в низких титрах (105 КОЕ/т).
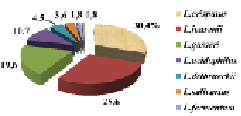
Рис. 3. Удельный вес идентифицированных лактобактерий (n = 112)
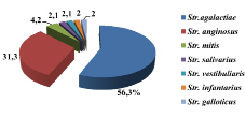
Рис. 4. Удельный вес идентифицированных видов семейства Streptococcaceae р. Streptococcus (n = 48)
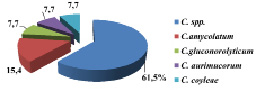
Рис. 5. Удельный вес идентифицированных видов р. Corynebacterium
Удельный вес идентифицированных видов семейства Streptococcaceae представлен на рис. 4.
Удельный вес идентифицированных видов рода. Corynebacterium представлен на рис. 5.
Метод, основанный на масс-спек- трометрическом профилировании рибосомальных белков микроорганизмов, позволил провести довидовую идентификацию культивируемых лактобактерий, коринебактерий и стрептококков группы viridans (всего 108 культур), которые в рутинной лабораторной практике идентифицируются до рода. Проведенные исследования показали, что у пациенток с лейкоцитарной реакцией в монокультуре в диагностически значимых титрах (более 104 КОЕ/т) в 3,8 раза чаще выявлялся S. aureus, факультативно-анаэробные бактерии (энтеробактерии, St. agalactiae, E. faecalis), L. gasseri, 1,4 раза чаще дрожжеподобные грибы рода Candida. У 52,9 % пациенток с выраженной лейкоцитарной реакцией условно-патогенные микроорганизмы выделялись в титрах 104-107 КОЕ/т, у 47,1 % пациенток – в высоких титрах 108-109 КОЕ/т. У каждой четвертой пациентки с воспалительным процессом урогенитального тракта диагностировались микробные ассоциации из 2 условно-патогенных агентов. У пациенток без лейкоцитарной реакции (менее 10 лейкоцитов в поле зрения) половые пути колонизировались дрожжеподобными грибами рода Candida (16 %) в титре более 104 КОЕ/т, при этом обычно в ассоциации с другими условно-патогенными возбудителями: E. coli, St. agalactiae, E. faecalis, G. vaginalis, St. aureus.
Выделенные штаммы U. urealyticum (n = 49) и M. hominis (n = 27) в 100 % были чувствительны к антимикробным препаратам тетрациклинового ряда (доксициклин), макролидам (пристинамицин, джозамицин). По отношению к фторхинолонам получены следующие результаты: отмечена 100 % чувствительность выделенных штаммов M. hominis к ципрофлоксацину, офлоксацину. Изоляты U. urealyticum в 71,4 % были резистентны, в 22,4 % умеренно-чувствительны, в 6,2 % чувствительны к ципрофлоксацину; в 38,8 % резистентны, в 53,1 % умеренно-чувствительны, в 8,1 % чувствительны к офлоксацину. Отмечена 100 % резистентность штаммов M. hominis к азитромицину, рокситромицину. 97,9 % изолятов U. urealyticum были чувствительны к азитромицину, 2,1 % – резистентны. В 95,8 % случаев отмечена чувствительность уреаплазм к рокситромицину, 2,1 % – умеренно-чувствительны, 2,1 % – резистентны.
У 11,4 % пациенток Ureaplasma spp. и Mycoplasma hominis выявлялись одновременно с факультативно-анаэробными микроорганизмами.
Заключение
Таким образом, комплексное клинико-лабораторное обследование пациенток с объективными и субъективными симптомами воспаления, с использованием инновационной микробиологической технологии масс-спектрометрии, позволило установить частоту встречаемости, расширить представления о видовом разнообразии условно-патогенной микрофлоры, провести количественную оценку. Установлено, что выделенные штаммы U. urealyticum и M. hominis в 100 % были чувствительны к доксициклину, пристинамицину, джозамицину, офлоксацину (61,2-100 % соответственно), цирофлоксацину (28,6-100 %). Отмечена 100 % резистентность M. hominis к азитромицину, рокситромицину, к которым большинство штаммов U. urealyticum были чувствительны. Увеличен спектр идентифицируемых видов Streptococcus, Corynebacterium, лактобактерий с применением высокотехнологичного метода MALDI TOF MS, что позволит уточнить этиологию воспалительного процесса урогенитального тракта.

