Во время высокоинтенсивных мышечных нагрузок усиление электрической активации диафрагмы и инспираторных мышц грудной клетки, а также вспомогательных инспираторных мышц шеи, таких как грудино-ключично-сосцевидные и лестничные мышцы, обеспечивает увеличение силы их сокращений и поддержание высоких уровней легочной вентиляции в соответствии с метаболическими запросами организма. Дыхательные мышцы человека обладают мощными резервными возможностями и адаптированы к выполнению продолжительной физической нагрузки, обеспечивая адекватную вентиляцию легких. Однако, как и другие скелетные, дыхательные мышцы подвержены развитию утомления, когда интенсивность и продолжительность их работы чрезвычайно высока, что, в свою очередь, может приводить к ограничению физической работоспособности человека [10]. Начальные признаки ухудшения функционального состояния инспираторной мускулатуры могут быть выявлены на основе анализа спектра мощности электромиографических сигналов еще до начала снижения силы мышечных сокращений и, соответственно, развиваемого ими инспираторного давления. Наиболее стабильным параметром, используемым при анализе спектра электрической активности мышц и оценки тонких изменений их функционального состояния, является центроидная частота спектра мощности ЭМГ [8]. Изменение частотного состава ЭМГ с перераспределением мощности в сторону более низких частот отражает ухудшение функционального состояния дыхательных мышц, и служит одним из критериев для выявления начальных признаков развития утомления [4]. Сдвиг ее значений в сторону преобладания низких частот наблюдается в диафрагме при длительном воздействии тяжелого резистивного сопротивления дыханию [3], тяжелой мышечной нагрузке [6], при циркуляторном (кардиогенном) шоке [7]. При повышении нагрузки на респираторную систему роль торакальных инспираторных мышц значительно возрастает, различные группы вспомогательных инспираторных мышц рекрутируются для обеспечения необходимых уровней легочной вентиляции [1]. Однако данных о сравнительной устойчивости основных и вспомогательных мышц к развитию их утомления, вызванного тяжелой физической нагрузкой, очень мало.
Целью настоящей работы явилось исследование функции инспираторных мышц при выполнении велоэргометрической нагрузки возрастающей мощности «до отказа» и оценка устойчивости диафрагмы, парастернальной, грудино-ключично-сосцевидной и лестничной мышц к развитию утомления методом электромиографического анализа.
Материалы и методы исследования
В исследовании принимали участие 15 добровольцев. Все обследуемые были подробно проинформированы о применяемых методиках, последовательности проведения исследований и дали письменное согласие на участие в них. Испытуемые были одного возраста, имели сходные антропометрические данные и соответствующие росту и весу спирометрические показатели, а также примерно одинаковый уровень физической подготовленности. Мышечную нагрузку возрастающей мощности испытуемые выполняли на спироэргометрической установке «Shiller» (Швейцария). Работа начиналась с нагрузки 1 Вт/кг и через каждые 5 мин ее величина возрастала на 0.5 Вт/кг, чередуясь с 1-минутными периодами отдыха. Работа продолжалась до невозможности поддержания заданного режима скорости вращения педалей (70 об/мин) и отказа испытуемого от ее продолжения. В покое и в процессе выполнения велоэргометрического теста производилась непрерывная регистрация и автоматический расчет объемно-временных параметров дыхания, показателей газообмена, а также регистрировалась электрическая активность диафрагмы, парастернальных, грудино-ключично-сосцевидных и лестничных мышц, участвующих в процессе инспирации. В качестве функциональной пробы, позволяющей оценить силовые резервные возможности инспираторных мышц, использовался маневр Мюллера. Измерение максимального инспираторного давления (MIP) производили с помощью портативного прибора PowerBreath KH1 (Великобритания). Измерения производили не менее 5 раз с перерывами в 1 минуту, в расчет принимали максимальное из достигнутых величин MIP. Регистрацию электрической активности диафрагмы, парастернальной, грудино-ключично-сосцевидной и лестничной мышц проводили с помощью поверхностных кардиографических электродов (ARBO, Германия). Для регистрации электрической активности диафрагмы (Д) электроды устанавливали в 8 и 9 межреберьях справа по ходу передней подмышечной линии. Электрическая активность парастернальных мышц (ПС) отводилась с помощью пары электродов, расположенной во 2-м межреберье справа на расстоянии 1-2 см от края грудины. Для регистрации активности грудино-ключично-сосцевидной (ГКС) и лестничной (Л) мышц электроды накладывались последовательно по ходу расположения волокон мышцы на расстоянии 1 см друг от друга c правой стороны. Электрические сигналы усиливались с помощью усилителя биопотенциалов с полосой пропускания от 10 до 1000 Гц (ГУАП, С.-Петербург). Усиленные сигналы с электромиографического усилителя подавались через аналогово-цифровой преобразователь и записывались на жестком диске компьютера с частотой дискретизации 1000 Гц для последующего анализа. Количественную оценку ЭМГ-сигналов производили по пиковой величине их интегрированной активности. Для оценки утомления различных инспираторных мышц использовался метод спектрального анализа ЭМГ. Для того, чтобы проследить частотный сдвиг спектра ЭМГ рассчитывалась центроидная частота (fc) до начала мышечной нагрузки и сразу же после ее прекращения. Полученные результаты статистически обрабатывали с использованием программ Microsoft Exel. Вычислялась средняя величина и ошибка средней. Различия считали статистически значимыми при Р < 0.05.
Результаты исследования и их обсуждение
В таблице представлены средние фоновые и максимальные вентиляторные параметры испытуемых, а также показатели общей и аэробной работоспособности.
Кардио-респираторные параметры и основные показатели работоспособности в покое и на последней минуте выполнения мышечной нагрузки «до отказа»
|
Параметры |
Контроль (покой) |
Последняя мин нагрузки |
|
Wmax, В |
221.2 ± 11.9 |
|
|
VE, л/мин |
8.1 ± 0.3 |
88.9 ± 6.7 |
|
VT, л |
0.6 ± 0.2 |
2.8 ± 0.2 |
|
fb, цикл/мин |
13.0 ± 2.1 |
33.1 ± 2.2 |
|
VO2, л/мин |
0.28 ± 0.02 |
3.2 ± 0.2 |
|
VO2, мл.кг-1.мин-1 |
3.99 ± 0.36 |
42.2 ± 0.8 |
|
VCO2, л/мин |
0.21 ± 0.01 |
3.28 ± 0.16 |
|
VCO2, мл.кг-1.мин-1 |
3.1 ± 0.28 |
41.9 ± 1.87 |
|
RER |
0.78 ± 0.06 |
1.14 ± 0.14 |
|
ЧСС, уд/мин |
76.4 ± 3.9 |
183.6 ± 5.4 |
|
O2-пульс, мл/уд |
3.5 ± 0.15 |
18.6 ± 1.4 |
|
PETCO2, мм рт.ст. |
32.68 ± 1.2 |
38.77 ± 2.23 |
|
PETO2, мм рт.ст. |
107.11 ± 2.6 |
115.34 ± 2.71 |
|
РWC170, В |
194.2 ± 22.2 |
|
|
РWC170, В/кг |
2.4 ± 0.4 |
|
|
AП, В |
206.1 ± 11.8 |
Данные представлены как среднее ± SE. Wmax, максимальная мощность выполненной нагрузки; VE, минутная вентиляция легких; VT, дыхательный объем; fb, частота дыхания; VO2, потребление кислорода; VCO2, выделение СО2; RER, дыхательный коэффициент; ЧСС, частота сердечных сокращений; O2-pulse, кислородный пульс; PETCO2, end-tidal CO2; PETO2, end-tidal O2; РWC170, мощность нагрузки при ЧСС 170 уд/мин; AП, порог анаэробного обмена.
Максимальная мощность выполненной нагрузки составила 221.2 ± 11.9 Вт. У всех испытуемых рост минутной вентиляции (VE) обеспечивался за счет увеличения как дыхательного объема (VT), так и частоты дыхания (f) и достигал, в срнднем, 88.9 ± 6.7 л/мин. Величина MIP, измеренная до начала выполнения велоэргометрического теста, составила 127.1 ± 8.2 см вод.ст., после нагрузки – 117.4 ± 8.8 см вод.ст., что было ниже контрольных значений на 8 % (P < 0.05). Снижение MIP наблюдалось у 12 из 15 испытуемых. В то же время, пиковые величины интегрированной электрической активности Д, ПС, ГКС и Л, зарегистрированные во время выполнения максимального инспираторного усилия после физической нагрузки, оказались достоверно выше, чем в контроле у всех обследуемых (рис. 1).
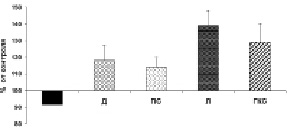
Рис. 1. Изменение максимального инспираторного давления (столбик черного цвета) и пиковой величины интегрированной электрической активности диафрагмы (Д), парастернальной (ПС), грудино-ключично-сосцевидной (ГКС) и лестничной (Л) мышц во время выполнения максимального инспираторного усилия (маневр Мюллера) после велоэргометрической нагрузки «до отказа» по отношению к контрольным значениям (до выполнения нагрузки), взятым за 100 %. Р < 0.05
Анализ изменения центроидной частоты спектра ЭМГ исследуемых инспираторных мышц показал, что ее значения после выполнения мышечной нагрузки были достоверно ниже, чем в контроле. Смещение значений центроидной частоты в сторону преобладания низкочастотной составляющей спектра ЭМГ после выполнения интенсивной мышечной нагрузки также является признаком развития мышечного утомления. Для того, чтобы сравнить степень устойчивости разных групп инспираторных мышц к развитию утомления у каждого испытуемого мы провели индивидуальный анализ изменений значений fc до и после выполнения нагрузки. Данные, представленные на рис. 2, отражают индивидуальный паттерн изменений fc Д, ПС, ГКС и Л мышц всех обследуемых после нагрузочного теста относительно фоновых данных, взятых за 100 %.

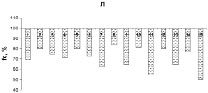
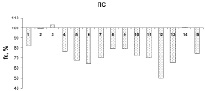
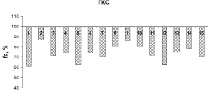
Рис. 2. Индивидуальные изменения величины центроидной частоты спектра ЭМГ диафрагмы (Д), парастернальной (ПС), грудино-ключично-сосцевидной (ГКС) и лестничной (Л) мышц у 15 испытуемых после выполнения мышечной нагрузки возрастающей мощности по отношению к контрольным данным (до выполнения нагрузки), взятым за 100 %
Достоверное снижение fc ГКС и Л мышц было выявлено у всех испытуемых. Отсутствие значимых изменений fc диафрагмы наблюдалось у пяти участников исследования (№ 5, 6, 7, 12 и 13), при этом у них отмечено существенное снижение fc ПС мышц (рис. 2). У трех испытуемых (№ 2, 3 и 14), наоборот, не обнаружено изменений значений fc ПС мышц, а fc диафрагмы существенно снижалась. У остальных семи обследуемых (№ 1, 4, 8, 9, 10, 11 и 15) отмечено параллельное снижение fc как Д, так и инспираторных мышц грудной клетки (рис. 2).
Полученные результаты ЭМГ-анализа показали, что после выполнения интенсивной нагрузки появляются признаки развития утомления инспираторной мускулатуры – снижение силы сокращения мышцы, несмотря на увеличивающийся уровень ее электрической активации. Так, значимое усиление электрической активности Д, ПС, ГКС и Л при выполнении маневра Мюллера в меньшей степени трансформируется в увеличение максимального инспираторного давления, что выражается в генерации сниженных, относительно контрольных, значений развиваемого давления. Этот факт свидетельствует о развитии утомления инспираторных мышц человека после выполнения тяжелой физической нагрузки. В данном случае можно говорить о развитии сократительного типа утомления мышц, при котором нарушается процесс сокращения мышечного волокна, в то время как его способность к возбуждению сохраняется. Такой тип утомления проявляется в снижении силы сокращения утомленной мышцы, несмотря на неизменный и даже увеличивающийся уровень ее электрической активации [9]. Нарушение процесса мышечного сокращения может быть связано с накоплением в мышце кислых продуктов обмена. Сдвиг внеклеточного рН в кислую сторону вызывает торможение выхода ионов Са2+ из саркоплазматического ретикулума и, как следствие, уменьшению активных взаимодействий между актином и миозином, а значит и ослаблению силы мышечных сокращений. Кроме того, обнаружен сдвиг частотной составляющей спектра мощности ЭМГ инспираторных мышц в сторону преобладания низких частот. На основе расчета значений центроидной частоты спектра ЭМГ выявлены различия в устойчивости разных групп инспираторных мышц к развитию утомления после их усиленной и продолжительной работы – вспомогательные инспираторные мышцы шеи обладают меньшей выносливостью и большей утомляемостью по сравнению с основными инспираторными мышцами. Обнаружен интересный факт – различный паттерн развития утомления диафрагмы и инспираторных мышц грудной клетки, возможно, в силу зависимости от преобладающего участия этих мышц в создании инспираторных усилий. Индивидуальный анализ сдвига значений центроидной частоты спектра ЭМГ влево, т.е. смещение в сторону низких частот, показал, что при интенсивных нагрузках возможно избирательное развитие утомления или диафрагмы, или инспираторных мышц грудной клетки, или и Д и ПС мышц одновременно. Вероятно, это может происходить из-за преимущественного вклада либо Д, либо ПС, либо этих мышц совместно в создание инспираторного усилия при выполнении интенсивной мышечной нагрузки в соответствии с вентиляторными запросами организма. Ранее на основе измерений трансдиафрагмального и эзофагального давлений у здоровых испытуемых было показано, что инспираторные мышцы грудной клетки более подвержены развитию утомления, чем диафрагма при дыхании с тяжелыми резистивными нагрузками [5]. Другие исследователи наблюдали избирательное утомление либо диафрагмы, либо парастернальных и грудино-ключично-сосцевидных мышц при дыхании с добавочным сопротивлением в зависимости от того, какой тип дыхания – торакальный или абдоминальный – был выбран испытуемыми произвольно [3]. Результаты настоящего исследования поддерживают это предположение и демонстрируют различную устойчивость диафрагмы и инспираторных мышц грудной клетки к развитию утомления при тяжелых мышечных нагрузках на фоне свободного дыхания в зависимости от преимущественного участия этих мышц в создании инспираторных усилий. В то же время все испытуемые в нашем исследовании показали значительное снижение центроидной частоты ГКС и Л мышц при выполнении нагрузки. Этот факт свидетельствует о том, что вспомогательные инспираторные мышцы шеи менее устойчивы к развитию утомления во время продолжительных интенсивных сокращений по сравнению с диафрагмой и торакальными мышцами. Различия в устойчивости основных и вспомогательных инспираторных мышц к утомлению могут быть связаны с разным волоконным составом мышц, запасом энергоемких метаболитов, буферными возможностями, регуляцией ионного обмена, плотностью капиллярной сети и количеством митохондрий в миоцитах [2].
Результаты исследования позволяют заключить, что при интенсивных мышечных нагрузках, сопряженных с многократным ростом легочной вентиляции и усиленной работой дыхательной мускулатуры, инспираторные мышцы здорового человека подвержены развитию утомления, что может вносить вклад в ограничение максимальной работоспособности. Вспомогательные инспираторные мышцы шеи менее устойчивы к утомлению во время длительных интенсивных сокращений по сравнению с диафрагмой и парастернальными мышцами. Утомление преимущественно диафрагмы или инспираторных мышц грудной клетки может развиваться избирательно или совместно в зависимости от паттерна рекрутирования этих инспираторных мышц и степени их участия в осуществлении инспираторного усилия. Целесообразно включение в общий тренировочный процесс спортсменов комплекса тренировок инспираторных мышц для увеличения их выносливости, основанного на дыхании с повышенными резистивными нагрузками.
Исследование выполнено при поддержке Программы Президиума РАН «Фундаментальные исследования для разработки биомедицинских технологий».

