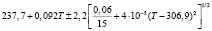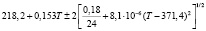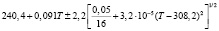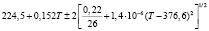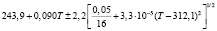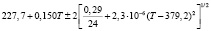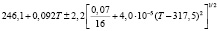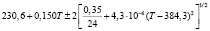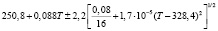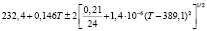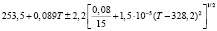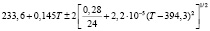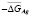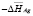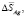Сложные халькогениды серебра и фазы переменного состава на их основе являются ценными функциональными материалами, обладающими термоэлектрическими, фотоэлектрическими, оптическими и др. свойствами. Некоторые из них обладают высокой ионной проводимостью по катиону Ag+ и могут быть использованы в качестве электрохимических сенсоров, электродов или электролитных материалов в устройствах электрохимического превращения энергии [3, 5, 7].
Для разработки и оптимизации методов синтеза и выращивания монокристаллов многокомпонентных халькогенидов серебра необходимы надежные данные по фазовым равновесиям и термодинамическим свойствам соответствующих систем. В работах [4, 6, 8] нами представлены результаты комплексного исследования фазовых равновесий и термодинамических свойств некоторых систем, составленных из бинарных и тройных халькогенидов серебра, германия и олова. В [1] установлено, что система Ag8GeSe6-Ag8SnSe6 квазибинарна и имеет фазовую диаграмму с непрерывными рядами твердых растворов между обеими модификациями исходных соединений.
Данная работа посвящена изучению термодинамических свойств твердых растворов Ag8GeSe6-Ag8SnSe6 методом ЭДС с твердым электролитом Ag4RbI5.
Исходные тройные соединения Ag8GeSe6 и Ag8SnSe6 плавятся конгруэнтно при 1176 и 1027 К и претерпевают полиморфные превращения при 321 и 355 К соответственно [3,10].
Низкотемпературная модификация Ag8GeSe6 имеет орторомбическую (пр.гр. Pmn21: Пр.гр. Pmn21, a = 0.7823, b = 0.7712, c = 1.0885нм) [3], а высокотемпературная – кубическую (Пр.гр.F-43m, a = 1.099 нм структуру) [10]. Обе кристаллические модификации соединения Ag8SnSe6 изоструктурны с Ag8GeSe6 и имеют следующие параметры: a = 0.79168, b = 0.78219, c = 1.10453 nm [9] и a = 1.112 nm [10].
Материалы и методы исследования
Для проведения исследований были синтезированы тройные соединения Ag8GeSe6 и Ag8SnSe6. Синтез проводили сплавлением стехиометрических количеств соответствующих элементарных компонентов высокой степени чистоты в вакуумированных (~ 10-2Па) кварцевых ампулах по методике в [1]. Индивидуальность синтезированных соединений контролировали методами ДТА и РФА.
Сплавлением исходных соединений в различных соотношениях в вакуумированных кварцевых ампулах синтезировали сплавы системы Ag8GeSe6-Ag8SnSe6, которые для гомогенизации отжигались при 900К в течение 500 ч. и охлаждались в режиме выключенной печи.
Исследования образцов проводили измерением ЭДС концентрационных цепей типа
(-) Ag (тв) / Ag4RbI5(тв) / (Ag в сплаве) (тв) (+) (1)
в которых электролитом служил твердый суперионный проводник Ag4RbI5, обладающий высокой ионной проводимостью уже при комнатной температуре [5]. Левым электродом служило металлическое серебро, а правыми электродами - равновесные сплавы исследуемой системы с различными составами.
ЭДС измеряли компенсационным методом с помощью цифрового вольтметра марки В7-34А в интервале температур 290/430 К. Измерения сначала проводили в температурном интервале существования высокотемпературных твердых растворов, а затем – низкотемпературных [1]. Первые равновесные значения были получены после 25-30 ч. после выдерживания ячейки при 380К, последующие – через каждые 3 ч. после установления определенной температуры. Равновесными считали те значения ЭДС, которые при неоднократном измерении при данной температуре отличались друг от друга не более, чем на 0,5 мВ независимо от направления изменения температуры.
Методика составления электрохимических цепей и измерений ЭДС подробно описаны в [2, 7].
Результаты исследования и их обсуждение
Результаты измерений ЭДС концентрационных цепей типа (1) представлены на рис. 1. Как видно, температурная зависимость ЭДС для каждого образца системы Ag8GeSe6-Ag8SnSe6 имеет вид двух прямых с точкой излома. Данные рис. 1 находятся в соответствии с результатами [1] об образовании непрерывных рядов твердых растворов между двумя модификациями исходных соединений, а температуры излома практически совпадают с температурами полиморфных переходов исходных соединений и твердых растворов.
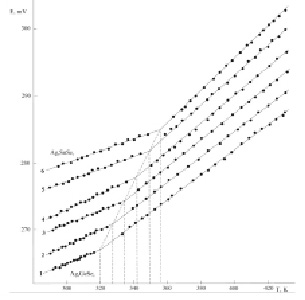
Рис. 1. Температурные зависимости ЭДС концентрационных цепей типа (1) для сплавов Ag8GeSe6-Ag8SnSe6: 1 – Ag8GeSe6; 2 – 20; 3 – 40; 4 – 60; 5 – 80 мол % Ag8SnSe6; 6 – Ag8SnSe6
Для проведения термодинамических расчетов результаты измерений ЭДС были обработаны в приближении их линейной температурной зависимости методом наименьших квадратов и представлены (табл. 1) в виде уравнений типа [2,7]:
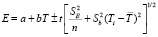
(t – критерий Стюдента, 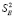 и
и 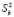 – дисперсии отдельных измерений ЭДС и коэффициента b, соответственно).
– дисперсии отдельных измерений ЭДС и коэффициента b, соответственно).
Таблица 1
Температурные зависимости ЭДС концентрационных цепей типа (1) для сплавов системы Ag8GeSe6-Ag8SnSe6
|
Фаза |
T, K |
E, мВ = a + bT ± tSE(T) |
|
(Ag8GeSe6)I |
298-317 |
|
|
(Ag8GeSe6)II |
325-430 |
|
|
(Ag8Ge0,8Sn0,2Se6)I |
290-325 |
|
|
(Ag8Ge0,8Sn0,2Se6)II |
330-430 |
|
|
(Ag8Ge0,6Sn0,4Se6)I |
290-330 |
|
|
(Ag8Ge0,6Sn0,4Se6)II |
340-430 |
|
|
(Ag8Ge0,4Sn0,6Se6)I |
290-335 |
|
|
(Ag8Ge0,4Sn0,6Se6)II |
345-430 |
|
|
(Ag8Ge0,2Sn0,8Se6)I |
290-340 |
|
|
(Ag8Ge0,2Sn0,8Se6)II |
355-430 |
|
|
(Ag8SnSe6)I |
298-350 |
|
|
(Ag8SnSe6)II |
360-430 |
|
Из данных табл. 1 по соотношениям [2]
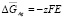
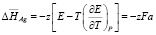
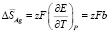
рассчитали парциальные молярные термодинамические функции серебра в высокотемпературных твердых растворах при 400 К и низкотемпературных при 298К (табл. 2).
Таблица 2
Относительные парциальные термодинамические функции серебра в системе Ag8GeSe6-Ag8SnSe6
|
Фаза |
T, K |
|
|
Дж/мол-1/К-1 |
|
кДж/мол-1 |
||||
|
(Ag8GeSe6)I |
298 |
25,582 ± 0,014 |
22,93 ± 0,38 |
8,88 ± 1,23 |
|
(Ag8GeSe6)II |
400 |
26,968 ± 0,017 |
21,05 ± 0,20 |
14,76 ± 0,55 |
|
(Ag8Ge0,8Sn0,2Se6)I |
298 |
25,812 ± 0,018 |
23,20 ± 0,37 |
8,78 ± 1,20 |
|
(Ag8Ge0,8Sn0,2Se6)II |
400 |
27,528 ± 0,019 |
21,66 ± 0,10 |
14,67 ± 0,72 |
|
(Ag8Ge0,6Sn0,4Se6)I |
298 |
26,121 ± 0,021 |
23,53 ± 0,38 |
8,68 ± 1,22 |
|
(Ag8Ge0,6Sn0,4Se6)II |
400 |
27,759 ± 0,022 |
21,97 ± 0,13 |
14,47 ± 0,93 |
|
(Ag8Ge0,4Sn0,6Se6)I |
298 |
26,391 ± 0,030 |
23,75 ± 0,43 |
8,88 ± 1,34 |
|
(Ag8Ge0,4Sn0,6Se6)II |
400 |
28,039 ± 0,023 |
22,25 ± 0,17 |
14,47 ± 1,27 |
|
(Ag8Ge0,2Sn0,8Se6)I |
298 |
26,729 ± 0,030 |
24,20 ± 0,27 |
8,49 ± 0,75 |
|
(Ag8Ge0,2Sn0,8Se6)II |
400 |
28,058 ± 0,018 |
22,42 ± 0,11 |
14,09 ± 0,72 |
|
(Ag8SnSe6)I |
298 |
25,582 ± 0,014 |
22,93 ± 0,38 |
8,88 ± 1,23 |
|
(Ag8SnSe6)II |
400 |
26,968 ± 0,022 |
21,05 ± 0,21 |
14,76 ± 0,55 |
Кривые концентрационных зависимостей этих функций при соответствующих температурах (рис. 2) имеют вид, характерный для систем, образующих неограниченные твердые растворы замещения.
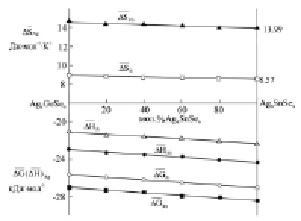
Рис. 2. Зависимости парциальных термодинамических функций серебра от состава в системе Ag8GeSe6-Ag8SnSe6 при 298К и 400К
Полученные значение парциальных молярных функций серебра позволили вычислить термодинамические функции полиморфного превращения соединений Ag8GeSe6 и Ag8SnSe6, а также промежуточных твердых растворов.
Теплота полиморфного превращения соединений может быть вычислена как разность теплот образования его модификаций
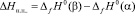 , (2)
, (2)
где Нп.п. – теплота полиморфного превращения соединения, 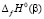 и
и 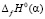 – теплоты образования двух модификаций. Согласно фазовой диаграмме [3], парциальные молярные функции серебра в Ag8GeSe6 относятся к потенциалобразующей реакции
– теплоты образования двух модификаций. Согласно фазовой диаграмме [3], парциальные молярные функции серебра в Ag8GeSe6 относятся к потенциалобразующей реакции
Ag (тв.) + 0,125GeSe2(тв.) + 0,5Se(тв.) = = 0,125 Ag8GeSe6 (тв.)
из которой следует, что GeSe2 вносит одинаковый вклад в функции 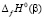 и
и 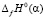 . Поэтому в соотношении (2) указанные интегральные термодинамические функции можно заменить соответствующими парциальными молярными функциями серебра
. Поэтому в соотношении (2) указанные интегральные термодинамические функции можно заменить соответствующими парциальными молярными функциями серебра
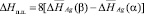 . (3)
. (3)
Это выражение более удобно для расчета DНп.п., так как в него не входит погрешность теплоты образования GeSe2. Энтропия полиморфного превращения вычислена по уравнению
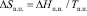
Аналогичные расчеты проведены для Ag8SnSe6 и твердых растворов Ag8Ge1-xSnxSe6 (табл. 3).
Таблица 3
Термодинамические функции полиморфных превращений исходных соединений и твердых растворов системы Ag8GeSe6-Ag8SnSe6
|
Фаза |
Tп.п., K |
Нп.п., кДж/мол-1 |
Sп.п, Дж/К-1мол-1 |
|
Ag8GeSe6 |
320 |
15,0 ± 4,6 |
47,0 ± 14,5 |
|
Ag8Ge0,8Sn0,2Se6 |
327 |
12,3 ± 3,8 |
37,6 ± 11,6 |
|
Ag8Ge0,6Sn0,4Se6 |
334 |
12,5 ± 4,1 |
37,4 ± 12,3 |
|
Ag8Ge0,4Sn0,6Se6 |
342 |
12,0 ± 4,8 |
35,1 ± 14,0 |
|
Ag8Ge0,2Sn0,8Se6 |
349 |
14,2 ± 3,0 |
40,7 ± 8,6 |
|
Ag8SnSe6 |
355 |
15,4 ± 4,7 |
43,3 ± 13,2 |
Относительно высокие погрешности полученных данных связаны с тем, что в методе ЭДС в отличие от свободной энергии Гиббса, энтальпия и энтропия рассчитываются косвенно из коэффициента температурной зависимости [2].
Заключение
Методом ЭДС с твердым Ag+ проводящим электролитом подтверждено образование непрерывных рядов твердых растворов Ag8Ge1-хSnхSe6 между высокотемпературными кубическими и низкотемпературными орторомбическими модификациями тройных соединений Ag8GeSe6 и Ag8SnSe6 и определены температуры их полиморфных превращений. Из данных измерений ЭДС вычислены парциальные свободная энергия Гиббса, энтальпия и энтропия серебра в обеих модификациях этих соединений и твердых растворов, а также теплоты и энтропии их полиморфных переходов.
Работа выполнена при поддержке Фонда Науки при Государственной Нефтяной Компании Азербайджанской Республики (Грант по проекту «Получение и исследование новых функциональных материалов на основе многокомпонентных халькогенидов металлов для альтернативных источников энергии и электронной техники», 2014).