Халькогениды тяжелых металлов и многокомпонентные фазы на их основе привлекают внимание исследователей в связи с их перспективностью для разработки новых термоэлектрических и других функциональных материалов электронной техники. В частности, квазитройные системы Ag2Te-АIVTe-BV2Te3 (АIV – Ge, Sn, Pb; BV- Sb, Bi) представляют интерес, так как их бинарные и тройные соединения считаются хорошими матричными фазами для этой цели [9, 6]. Тетрадимитоподобные бинарные (BV2Te3) и тройные соединения АIVBV2Te4, АIVBV4Te7 и АIVBV6Te10 и др. являются топологическими изоляторами и могут быть использованы в спинтронике [2, 11]. Для поиска и разработки физико-химических основ получения новых многокомпонентных фаз и материалов на основе этих соединений целесообразно исследование фазовых равновесий и термодинамических свойств соответствующих систем.
В [1, 3] нами построена фазовая диаграмма системы Ag2Te-SnTe-AgBiTe2, согласно которой система характеризуется образованием широкой непрерывной полосы высокотемпературных твердых растворов с кубической структурой вдоль разреза SnTe-AgBiTe2. При понижении температуры (Т ≤ 715 К) происходит твердофазный распад AgBiTe2 и твердых растворов вблизи этого соединения (> 80 мол % AgBiTe2) с образованием Bi2Te3, низкотемпературной модификации Ag2Te и тройных фаз граничной системы SnTe-Bi2Te3.
В настоящей работе представлены результаты термодинамического исследования твердых растворов в системе 2SnTe-AgBiTe2 методом ЭДС с твердым Ag+ проводящим электролитом Ag4RbI5.
Теллурид олова, плавящийся конгруэнтно при 1079 К, непосредственно кристаллизуется из расплавов стехиометрического состава [10]. Поэтому его синтез проводили сплавлением элементарных компонентов высокой степени чистоты в вакуумированной (~ 10-2Па) кварцевой ампуле при температуре 1150 К с последующим медленным охлаждением. Синтезированный SnTe идентифицировали методами ДТА и РФА.
Соединение AgBiTe2 также плавится конгруэнтно (828К), но при понижении температуры разлагается по твердофазной реакции при 716 К [5]. Учитывая это, сплавы системы 2SnTe-AgBiTe2 с составами 10, 20, 40, 60 и 80 мол % AgBiTe2 готовили из предварительно синтезированного и идентифицированного SnTe и элементарных Ag, Bi и Te методом сплавления в условиях вакуума. Составы сплавов выбирали исходя из фазовой диаграммы системы SnTe-AgBiTe2 [1].
С целью устранения неоднородности твердых растворов по составу и достижения состояния, максимально близкого к равновесному, литые негомогенизированные сплавы, полученные медленным охлаждением расплавов, были перетерты в порошок, тщательно перемешены и запрессованы в таблетки массой 0,8-1 г, а затем отожжены при 700 К в течение 1000 ч.
Для проведения экспериментов методом ЭДС были составлены концентрационные цепи типа
(-) Ag (тв) | Ag4RbI5 (тв) | (Ag в сплаве) (тв) (+) (1)
Твердый электролит Ag4RbI5 синтезировали из химически чистых RbI и AgI по методике [7]: стехиометрическую смесь исходных йодидов расплавили в кварцевой ампуле в вакууме (~ 10-2Па) и затем быстро охлаждали до комнатной температуры. При охлаждении расплав кристаллизуется в мелкозернистое и микроскопически однородное тело. Последующий отжиг при 400 К в течение 200 ч. приводит к полной гомогенизации Ag4RbI5. Из полученного цилиндрического слитка диаметром ~ 1 см вырезали таблетки толщиной 4-6 мм, которые использовали как твердый электролит в цепях типа (1).
Для приготовления правых электродов отожженные сплавы стирали в порошок, а затем запрессовывали в виде таблеток массой 0,5-1 г. Была собрана электрохимическая ячейка, описанная в [7], которую вакуумировали, наполнили аргоном и поместили в специально изготовленную трубчатую печь сопротивления, где она термостатировалась при температуре ~ 380 К в течение 40-50 часов. Температуру ячейки измеряли хромель-алюмелевыми термопарами и ртутными термометрами с точностью ± 0,5 °С.
ЭДС измеряли компенсационным методом с помощью цифрового вольтметра марки В7-34А. Измерения проводили через каждые 3 часа после установления определенной температуры. Равновесными считали те значения ЭДС, которые при неоднократном измерении при данной температуре отличались друг от друга не более, чем на 0,5 мВ независимо от направления изменения температуры. С целью устранения возникновения термо-э.д.с контакты всех токоотводов с медным проволоками имели одинаковую температуру.
Результаты измерений ЭДС цепей типа (1) находились в соответствии с данными [1] об образовании широкой области твердых растворов на основе SnTe. Измерения показали, что при заданной температуре в области составов < 80 мол % AgBiTe2 значения ЭДС являются монотонной функцией состава, а при составах с большей концентрацией AgBiTe2 остаются постоянными независимо от валового состава сплавов. Это подтверждает данные [5] о наличии широкой (до 80 мол %) области твердых растворов на основе SnTe по разрезу 2SnTe-AgBiTe2.
Для проведения термодинамических расчетов результаты измерений ЭДС были обработаны в приближении их линейной температурной зависимости методом наименьших квадратов и представлены (табл. 1) в виде уравнений типа [7]:
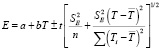
где 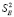 – дисперсии отдельных измерений ЭДС при температурах Ti;
– дисперсии отдельных измерений ЭДС при температурах Ti; 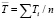 ; n – число пар значений Е и Т; t – критерий Стюдента. При доверительном интервале 95 % и n ≥ 20 критерий Стюдента t ≤ 2.
; n – число пар значений Е и Т; t – критерий Стюдента. При доверительном интервале 95 % и n ≥ 20 критерий Стюдента t ≤ 2.
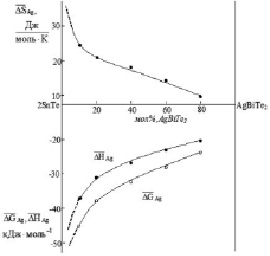
Зависимости парциальных термодинамических функций серебра от состава в сплавах SnTe-AgBiTe2 при 298 К
Из данных табл. 1 рассчитали парциальные молярные термодинамические функции серебра (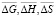 ) в сплавах при 298 К (табл. 2).
) в сплавах при 298 К (табл. 2).
Кривые концентрационных зависимостей этих функций при 298 К (рисунок) имеют вид, характерный для систем с образованием твердых растворов. В пределах области гомогенности α-твердых растворов на основе SnTe парциальные молярные функции серебра являются монотонными функциями состава, а в гетерогенной области α + b + g (b-твердые растворы на основе AgBiTe2 [5]) имеют постоянные значения, так как составы сосуществующих фаз являются постоянными.

Зависимости парциальных термодинамических функций серебра от состава в сплавах SnTe-AgBiTe2 при 298 К
С уменьшением концентрации серебра в твердых растворах происходит понижение 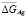 и
и 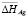 и повышение
и повышение 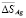 , что соответствует положениям термодинамики растворов [7]. На границе гомогенности α-фазы не выявлены заметные скачки парциальных энтропии и энтальпии, что подтверждает вертикальность этой границы на фазовой диаграмме системе SnTe-AgBiTe2 в температурном интервале измерений ЭДС [1].
, что соответствует положениям термодинамики растворов [7]. На границе гомогенности α-фазы не выявлены заметные скачки парциальных энтропии и энтальпии, что подтверждает вертикальность этой границы на фазовой диаграмме системе SnTe-AgBiTe2 в температурном интервале измерений ЭДС [1].
Данные [1,3] по фазовым равновесиям в системе Ag-Sn-Bi-Te позволили составить уравнения потенциалобразующих реакций для отдельных составов твердых растворов по методике, описанной в [7]. Например, согласно [1, 3], лучевая прямая, исходящая из угла элементарного серебра и проходящая через состав (2SnTe)0,9(AgBiTe2)0,1 твердого раствора пересекает граничную тройную систему Sn-Bi-Te в точке Sn1,8Bi0,1Te2. Эта точка находится в трехфазной области SnTe + SnBi2Te4 + Te. Поэтому потенциалобразующая реакция описывается уравнением
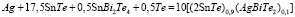
Таблица 2
Относительные парциальные термодинамические функции серебра в сплавах (2SnTe)x(AgBiTe2)1-x при 298К
|
Состав |
|
|
Дж/К-1 моль |
|
кДж/моль-1 |
|||
|
(2SnTe)0,9(AgBiTe2)0,1 |
45,55 ± 0,06 |
37,42 ± 0,27 |
23,9 ± 0,8 |
|
(2SnTe)0,8(AgBiTe2)0,2 |
37,71 ± 0,07 |
31,50 ± 0,33 |
20,8 ± 0,9 |
|
(2SnTe)0,6(AgBiTe2)0,4 |
32,13 ± 0,06 |
26,84 ± 0,25 |
17,8 ± 0,7 |
|
(2SnTe)0,4(AgBiTe2)0,6 |
27,11 ± 0,07 |
23,00 ± 0,31 |
13,8 ± 0,8 |
|
(2SnTe)0,2(AgBiTe2)0,8 |
23,89 ± 0,08 |
20,29 ± 0,36 |
9,3 ± 0,9 |
Таблица 3
Стандартные интегральные термодинамические функции твердых растворов 2SnTe-AgBiTe2
|
Соединение |
|
|
Дж/К-1 моль |
|
кДж/моль-1 |
|||
|
SnTe [10] |
61,1 ± 1,0 |
61,1 ± 1,0 |
101,3 ± 4,2 |
|
SnBi2Te4 [11] |
173,1 ± 2,7 |
170,5 ± 2,1 |
374 ± 14 |
|
(2SnTe)0,9(AgBiTe2)0,1 |
121,1 ± 1,9 |
119,2 ± 1,9 |
200,8 ± 8,1 |
|
(2SnTe)0,8(AgBiTe2)0,2 |
116,5 ± 1,8 |
115,0 ± 1,8 |
198,5 ± 7,9 |
|
(2SnTe)0,6(AgBiTe2)0,4 |
108,6 ± 1,6 |
105,9 ± 1,5 |
193,1 ± 7,3 |
|
(2SnTe)0,4(AgBiTe2)0,6 |
98,8 ± 1,4 |
95,5 ± 1,3 |
186,0 ± 6,8 |
|
(2SnTe)0,2(AgBiTe2)0,8 |
88,4 ± 1,1 |
84,4 ± 1,1 |
176,8 ± 6,4 |
Согласно этому уравнению термодинамические функции образования фазы (2SnTe)0,9(AgBiTe2)0,1 вычислены по соотношению
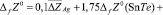
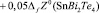
где 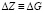 или Н, а энтропия – по соотношению
или Н, а энтропия – по соотношению
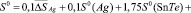
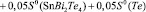
Аналогичным путем вычислены стандартные термодинамические функции образования и стандартные энтропии твердых растворов других составов. Результаты представлены в табл. 3.
При расчетах в соответствии с уравнениями реакция потенциалобразования использованы литературные данные по соответствующим стандартным интегральным термодинамическим функциям соединений SnTe [6], SnBi2Te4 и SnBi4Te7 [4] (табл. 3) а также элементарных серебра и селена, рекомендованные в справочнике [8], как наиболее надежные (табл. 3). Погрешности находили методом накопления ошибок.


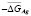
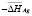
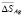 ,
,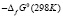
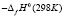
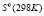 ,
,