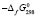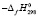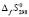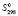Халькогерманаты серебра являются перспективными функциональными материалами, обладающими интересными полупроводниковыми, фото- и термоэлектрическими и др. свойствами [5]. Оптимизация технологических режимов синтеза и выращивания монокристаллов новых многокомпонентных фаз и материалов на их основе требует наличия взаимосогласованную информацию для термодинамических и фазовых характеристик халькогенидных тройных систем, в частности для системы Ag-Ge-Se. В работе [1,9] в системе Ag-Ge-Se выявлены две тройные соединения Ag8GeSe6 и Ag2GeSe3. Если Ag8GeSe6 является конгруэнтно плавящимся соединением, то второе тройное соединение отсутствует в фазовых диаграммах, построенных на основании результатов РФА и ДТА в [6]. Возможно, соединение Ag2GeSe3 неустойчиво и распадается на фазы Ag8GeSe6 и GeSe2.
Целью нашей работы является оценка термодинамической устойчивости тройных соединений Ag8GeSe6 и Ag2GeSe3 относительно двойных соединений Ag2Se, GeSe и GeSe2 и триангуляция тройной систем Ag-Ge-Se.
Термодинамические расчеты и обсуждение
Термодинамические функции образования соединений Ag2Se, GeSe и GeSe2
Термодинамические функции образования соединений Ag2Se, GeSe и GeSe2 использовали для расчета термодинамических функция образования тройных соединений из двойных соединений. При этом проанализировали исходные источники, из которых заимствованы справочные данные. Термодинамические данные для соединений Ag2Se и GeSe, приведенных в различных источниках, находятся в соответствии [2, 3]. В то же время значения энтальпии образования соединения GeSe2, полученные разными авторами [7, 8] существенно отличаются. В работе [7] методом фторной калориметрии для стандартной энтальпии образования кристаллического и стеклообразного GeSe2 при 298.15 К получены следующие величины, соответственно: 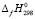 (GeSe2,кр) = - (103.7 ± ± 3.1) кДж·мол·1 и
(GeSe2,кр) = - (103.7 ± ± 3.1) кДж·мол·1 и 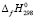 (GeSe2, cт) = - (91.6 ± 3.2) кДж·мол·1 . Стандартная энтальпия фазового перехода: GeSe2 (ст.) = GeSe2 (кр), составляет (-12.1 ± ± 4.2) кДж.моль-1. В работе [8] методом прямой калориметрии для стандартной энтальпии образования кристаллического и стеклообразного (аморфного) GeSe2 получены следующие величины
(GeSe2, cт) = - (91.6 ± 3.2) кДж·мол·1 . Стандартная энтальпия фазового перехода: GeSe2 (ст.) = GeSe2 (кр), составляет (-12.1 ± ± 4.2) кДж.моль-1. В работе [8] методом прямой калориметрии для стандартной энтальпии образования кристаллического и стеклообразного (аморфного) GeSe2 получены следующие величины 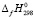 (GeSe2,кр) = -(84.4 ± 2)кДж·мол·1 и
(GeSe2,кр) = -(84.4 ± 2)кДж·мол·1 и 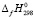 (GeSe2,cт) = -(76.5 ± 1) кДж·мол·1. Стандартная энтальпия фазового перехода: GeSe2 (ст.) = GeSe2 (кр), составляет (-7.9 ± ± 2.1) кДж.моль-1. Значение
(GeSe2,cт) = -(76.5 ± 1) кДж·мол·1. Стандартная энтальпия фазового перехода: GeSe2 (ст.) = GeSe2 (кр), составляет (-7.9 ± ± 2.1) кДж.моль-1. Значение 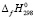 (GeSe2,кр) = - (62.8 ± 3.1) кДж.моль-1, представляется нам весьма заниженным. Значения стандартной энтропии Ag2Se, GeSe и GeSe2, приведенные в различных работах [2, 3, 8], не вызывали сомнения. Значения
(GeSe2,кр) = - (62.8 ± 3.1) кДж.моль-1, представляется нам весьма заниженным. Значения стандартной энтропии Ag2Se, GeSe и GeSe2, приведенные в различных работах [2, 3, 8], не вызывали сомнения. Значения 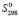 , а также энтропии образования
, а также энтропии образования 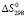 этих соединений приведены в табл. 1. Стандартные свободные энергии образования соединений, приведенные в табл. 1 вычислены по уравнению Гиббса-Гельмгольца:
этих соединений приведены в табл. 1. Стандартные свободные энергии образования соединений, приведенные в табл. 1 вычислены по уравнению Гиббса-Гельмгольца:
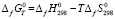 (1)
(1)
Для анализа зависимости свободной энергии образования соединений от состава на рис. 1 вначале вычислим свободную энергию реакции
GeSe(kr) + Se (kr) → GeSe2(kr) + 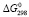 (2)
(2)
По данным [7]: 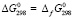 (GeSe2, кр)-
(GeSe2, кр)-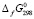 (GeSe,кр) = -103.7-(-84.2) = = -19.5 кДж.моль-1 (рис. 1, кр. 1). По данным [8]:
(GeSe,кр) = -103.7-(-84.2) = = -19.5 кДж.моль-1 (рис. 1, кр. 1). По данным [8]: 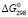 = -83.6-(-84.2 = 0.6 кДж. моль-1 (рис. 1, кр. 2). По данным [7]:
= -83.6-(-84.2 = 0.6 кДж. моль-1 (рис. 1, кр. 2). По данным [7]: 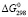 = -62.8-(-84.2 = 21.4 кДж.моль-1 (рис. 1, кр. 3). Последние две значения для свободной энергии реакции (2) не соответствуют действительности (рис. 1, кр. 2,3). Отметим, что GeSe является перитектическим соединением, а соединение GeSe2 является конгруэнтно плавящимся соединением с температурой плавления 742 °С.
= -62.8-(-84.2 = 21.4 кДж.моль-1 (рис. 1, кр. 3). Последние две значения для свободной энергии реакции (2) не соответствуют действительности (рис. 1, кр. 2,3). Отметим, что GeSe является перитектическим соединением, а соединение GeSe2 является конгруэнтно плавящимся соединением с температурой плавления 742 °С.
Термодинамические функции образования соединений Ag8GeSe6 и Ag2GeSe3
В работе [4] термодинамические функции образования кристаллических Ag8GeSe6 и Ag2GeSe3 определены измерением ЭДС концентрационных цепей типа (-) Ag (тв) | Ag4RbI5 (тв) | (Ag-Ge-Se) (тв) (+) в интервале температур 300-430К. В работе [9] термодинамические функции образования стеклообразных фаз на основе этих соединений определены измерением ЭДС концентрационных цепей типа (-) Ag (тв) | AgI (тв) | (Ag-Ge-Se) (стекло) (+) в интервале температур 480-580К.
Термодинамические функции образования соединений Ag8GeSe6 и Ag2GeSe3 также определили в этой работе расчетным путем, на основании данных двойных соединений Ag2Se и GeSe2 в табл. 1 по уравнению:
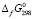 (Ag2GeSe3,кр) =
(Ag2GeSe3,кр) = 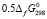 (Ag2Se ,кр) +
(Ag2Se ,кр) + 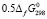 (GeSe2,кр) = –153.3кДж.моль-1 (3)
(GeSe2,кр) = –153.3кДж.моль-1 (3)
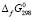 (Ag8GeSe6,кр) =
(Ag8GeSe6,кр) = 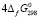 (Ag2Se ,кр) +
(Ag2Se ,кр) + 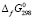 (GeSe2,кр) = –303.1кДж.моль-1 (4)
(GeSe2,кр) = –303.1кДж.моль-1 (4)
Поскольку химические реакции протекают убыванием свободной энергии Гиббса, то свободные энергии образования стабильных соединений должны быть больше (по абсолютной величине) от аддитивно вычисленных величин в (3,4).
Из рис. 2 следует, что приведенные в работе значения 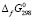 (Ag2GeSe3) меньше аддитивных величин в (3,4), что свидетельствует о термодинамической неустойчивости соединения Ag2GeSe3. В этой работе синтезировали и исследовали сплав этого состава. На основании РФА было выявлено, что соединение Ag2GeSe3 получается в стеклообразном состоянии при быстром охлаждении расплава. После отжига сплава РФА показал отсутствие линий для соединения Ag2GeSe3. Поэтому при триангуляции системы Ag-Ge-Se предполагали, что в этой системе в кристаллическом состоянии образуется только одно тройное соединение Ag8GeSe6 (рис. 3). Стандартную энтропию Ag8GeSe6 также определили расчетным путем по уравнению [10]:
(Ag2GeSe3) меньше аддитивных величин в (3,4), что свидетельствует о термодинамической неустойчивости соединения Ag2GeSe3. В этой работе синтезировали и исследовали сплав этого состава. На основании РФА было выявлено, что соединение Ag2GeSe3 получается в стеклообразном состоянии при быстром охлаждении расплава. После отжига сплава РФА показал отсутствие линий для соединения Ag2GeSe3. Поэтому при триангуляции системы Ag-Ge-Se предполагали, что в этой системе в кристаллическом состоянии образуется только одно тройное соединение Ag8GeSe6 (рис. 3). Стандартную энтропию Ag8GeSe6 также определили расчетным путем по уравнению [10]:
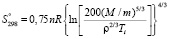 (5)
(5)
Здесь n – число атомов в молекуле Ag8GeSe6, R = 8.31 Дж.моль-1.К-1, M = 1410 – мольярная масса, Ti = 1158 К температура плавления, r = 7.1 плотность в г.см-3. Значение стандартной энтропии Ag8GeSe6, вычисленное по уравнению (5), практически совпадает (таблица) с результатом измерения ЭДС [4].
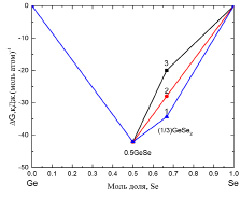
Рис. 1. Зависимости свободной энергии образования селенида и дисульфида германия в кристаллическом состоянии от состава: 1-по [7], 2-[8],3-[3]
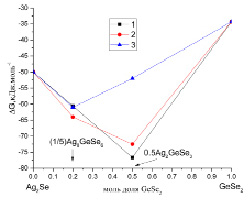
Рис. 2. Зависимости свободной энергии образования тройных соединений в кристаллическом состоянии от состава: 1-аддивный расчет по урав.(3,4), 2-[4], 3-[9]
Термодинамические функции соединений в кристаллическом состоянии
|
Вещество |
|
|
|
|
|
кДж.моль-1 |
Дж.моль-1.К-1 |
|||
|
α-Ag2Se |
50.3 ± 2[3] |
43.5 ± 0.5[3] |
22.7 ± 1 |
150.3 ± 1.5[3] |
|
GeSe |
84.2 ± 5[3] |
82.9 ± 5[3] |
5.18 ± 0.5 |
78.3 ± 1[3] |
|
GeSe2 |
103.1 ± 2.0[7] |
103.7 ± 3.1 [7] |
2.52 ± 0.1 |
112.6 ± 2[7] |
|
α-Ag8GeSe6 |
312.4 ± 5[4] |
290.8 ± 5[4] |
75.2 ± 6 |
699.1 ± 10[4] |
|
288.6 ± 5[9] |
261.8 ± 5[9] |
90.4 ± 5 |
714.4 ± 10[9] |
|
|
303.4 ± 5 аддитивный расчет по уравн.(4) |
278.4 ± 5 аддитивный расчет |
70.4 ± 5 |
696.2 ± 10 Расчет по уравн.(5) |
|
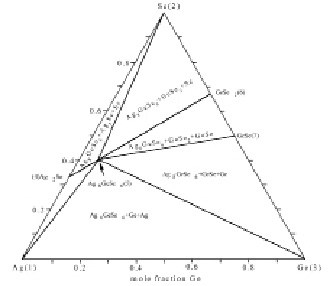
Рис. 3. Фазовые области системы Ag-Se-Ge в температурном интервале 300-500 К
Триангуляция системы Ag-Ge-Se
Для практического использования фазовых диаграмм тройных систем со сложным взаимодействием компонентов целесообразно их разделить на симплексы – квазибинарные, квазитройные и взаимные системы. Разделение системы Ag-Ge-Se на квазитройные системы с учетом образования одного тройного соединения Ag8GeSe6 представлено на рис. 3.
При переходе от одного стандартного состояния к другому пересчитываются концентрации компонентов. Для упрощения этой задачи и выполнения расчетов на компьютере целесообразно использовать матрицы, связывающие концентрации компонентов тройной системы Ag-Ge-Se с компонентами ее подсистем. Связь между концентрацией (моль доля) компонентов (zi) тройной системы и ее подсистем (xi) выражается формулами:
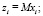
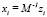 (6)
(6)
Здесь М и М-1 – квадратная матрица третьего порядка и обратная матрица, указывающие концентрации компонентов в узлах тройной системы и подсистем, соответственно.
Для подсистемы 1–4–5 (рис. 3):
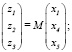
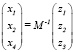 (7)
(7)
где z1, z2, z3 моль. доли Ag, Se, Ge в тройной системе Ag-Se-Ge; x1, x4, x5 – моль доли Ag, Ag0.667Se0.333 (Ag2Se) и Ag0.533Ge0.067Se0.4 (Ag8GeSe6) в квазитройной системе 1–4–5.
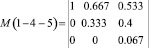 ;
;
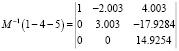 (8)
(8)
Следовательно,
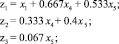
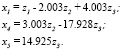
Для остальных квзитройных систем 4-2-5, 5-2-6, 5-6-7, 5-7-3 и 1-5-3 (рис. 3) представляем только прямые М матрицы, на основании которых с помощью компьютера можно определить обратные матрицы.
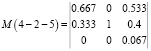 ,
,
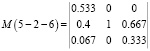 ,
,
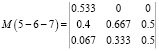 ,
,
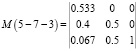 ,
,
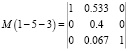 .
.
Заключение
Тройная система Ag-Ge-Se с образованием одного конгруэнтно плавящегося тройного соединения Ag8GeSe6 с помощью матриц третьего порядка разделена на 6 квазитройных подсистем Ag-Ag2Se-Ag8GeSe6, Ag2Se-Ag8GeSe6-Se, Ag8GeSe6-GeSe2-Se, Ag8GeSe6-GeSe2-GeSe, Ag8GeSe6-GeSe-Ge, Ag8GeSe6-Ag-Ge.