В последнее время наблюдается постоянный рост смертности населения РФ от неинфекционных заболеваний (НИЗ), основную угрозу состоянию здоровья граждан представляют заболевания сердечно-сосудистой системы (ССС) [2]. Известно, что своевременная и качественно организованная профилактика заболеваний сердца и сосудов позволяет сократить смертность на 30-35 %, для сравнения – проведение лечебных мероприятий, таких как стентирование, позволяет снизить уровень смертности лишь на 1-5 % [3]. На современном фармацевтическом рынке огромную долю занимают препараты, предназначенные для профилактики и лечения заболеваний ССС, в большинстве своём представленные дженериками. Поэтому изучение биоэквивалентности и биодоступности препаратов, предназначенных для лечения и профилактики заболеваний ССС, является актуальной и социально значимой проблемой современного фармацевтического анализа.
Одним из наиболее распространённых лекарственных веществ, используемых в комплексной терапии и профилактике различных заболеваний ССС, является кислота ацетилсалициловая (Аспирин Кардио, Тромбо АСС, Кардиомагнил, и др.). Кислота ацетилсалициловая является производным салициловой кислоты, проявляет следующие фармакологические свойства: анальгезирующее, жаропонижающее, противовоспалительное, антиагрегационное. Ингибирует циклооксигеназу (ЦОГ-1 и ЦОГ-2) и необратимо тормозит циклооксигеназный путь метаболизма арахидоновой кислоты, блокирует синтез простагландинов и тромбоксана. Уменьшение содержания тромбоксана А2 в тромбоцитах приводит к необратимому подавлению агрегации, несколько расширяет сосуды [4, 6].
Таким образом, препараты кислоты ацетилсалициловой являются практически незаменимыми при лечении различного рода воспалительных процессов, болевого синдрома, а также – профилактики заболеваний ССС вследствие антиагрегационного действия. Назначение препаратов кислоты ацетилсалициловой лицам, подверженным риску заболеваний сердца и сосудов, является обязательным и зачастую пожизненным. Поэтому крайне важно обеспечивать население качественными и доступными препаратами данного лекарственного вещества. Однако, применение дженериков низкой стоимости повышает риск снижения терапевтического эффекта из-за вероятной низкой биоэквивалентности препарата. Как следствие, разработка экспресс-методов точного определения биодоступности и биоэквивалентности препаратов кислоты ацетилсалициловой является актуальной задачей. Одним из таких методов анализа является спектрофотометрия в ультрафиолетовой области спектра (УФ-спектрофотометрия).
Биодоступность – это скорость и степень, с которой активная субстанция всасывается из готовой лекарственной формы и накапливается в месте ее предполагаемого действия. Два лекарственных препарата биоэквивалентны, если они фармацевтически эквивалентны или альтернативны и если их биодоступность после введения в одинаковой молярной дозе сходна в такой степени, что их эффективность и безопасность в основном одинаковы [8]. Наиболее эффективными методами изучения биоэквивалентности являются методы in vivo. Однако, данные методы до сих пор остаются самыми дорогостоящими и технически сложными фармацевтическими испытаниями, поэтому предварительные испытания биодоступности возможно проводить методами in vitro, например, определение кинетики растворения для таблетированных лекарственных форм [7].
Для определения концентрации кислоты ацетилсалициловой в жидкой среде возможно применить метод спектрофотометрии в УФ и видимой области спектра, метод является точным, чувствительным, доступным и не требует больших затрат времени [1, 5, 9, 10].
Цель нашего исследования – разработка доступного экспресс-метода качественного и количественного определения кислоты ацетилсалициловой для целей изучения биоэквивалентности и биодоступности. Методика спектрофотометрического определения кислоты ацетилсалициловой может быть использована в обычных лабораториях, исключает применение дорогостоящего оборудования, высокотоксичных и летучих реактивов.
Материалы и методы исследования
Исследуемые образцы с концентрациями 0,02, 0,04, 0,06, 0,08 и 0,1 мг/мл готовили с использованием субстанции лекарственного вещества «Кислота ацетилсалициловая» («Омскхимреактив», Россия), спирта этилового 96 % («Омская фармацевтическая фабрика», Россия), 0,1М раствора кислоты хлористоводородной («Омскхимреактив», Россия). Качество использованных субстанций и реактивов соответствует требованиям Государственной Фармакопеи РФ XIII изд.
Оборудование: спектрофотометр СФ-2000, набор кварцевых кювет, набор лабораторной посуды.
Методика:
1. Приготовление серии разведений исследуемых растворов: в мерные колбы на 50 мл помещали по 0,05 г (т.н.) субстанции кислоты ацетилсалициловой, прибавляли 20 мл спирта этилового, встряхивали до растворения и доводили до метки спиртом этиловым (раствор А); в мерные колбы на 100 мл помещали соответственно по 2,0, 4,0, 6,0, 8,0 и 10,0 мл раствора А и доводили 0,1М раствором кислоты хлористоводородной до метки (исследуемые растворы); полученные растворы спектрофотометрировали в интервале длин волн 200-759 нм в кварцевых кюветах с длиной оптического пути 1 см на спектрофотометре СФ-2000.
2. Приготовление модельных растворов: в мерные колбы на 50 мл помещали по 0,0314 г (I, т.н.) или по 0,0335 г (II, т.н.) субстанции кислоты ацетилсалициловой, далее поступали, как при приготовлении серии разведений исследуемых растворов; полученные растворы спектрофотометрировали в тех же условиях.
Статистическую обработку результатов эксперимента проводили с использованием пакета программ Statistica 6.0 для доверительной вероятности р = 0,95.
Результаты исследования и их обсуждение
Выбор растворителей при приготовлении серий разведений обусловлен физико-химическими свойствами исследуемого вещества, а также условиями проведения теста «Растворение» для таблетированных/капсулированных лекарственных форм. Кислота ацетилсалициловая легко растворима в спирте этиловом 96 %, растворима в хлороформе и мало растворима в воде, поэтому для приготовления раствора А использовали в качестве растворителя спирт этиловый 96 %. Кислота ацетилсалициловая, как вещество кислотного характера, подвергается наибольшему всасыванию в желудке, поэтому изучение растворения таблетированных лекарственных форм необходимо проводить, используя в качестве растворителя 0,1М раствор кислоты хлористоводородной (ОФС.1.4.2.0014.15), поэтому при приготовлении исследуемых растворов в качестве растворителя использовали 0,1М раствор кислоты хлористоводородной.
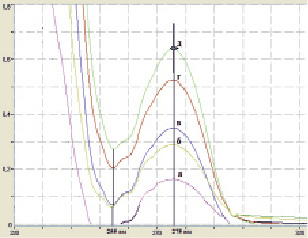
Рис. 1. Спектры поглощения кислоты ацетилсалициловой в исследуемых растворах для концентраций, мг/мл: а – 0,02, б – 0,04, в – 0,06, г – 0,08. д – 0,1
Таблица 1
Статистические параметры результатов спектрофотометрирования исследуемых растворов (n = 5, р = 0,95)
|
С (мг/мл) |
Аср |
Sr |
А, σ |
Аср ± ΔА |
|
0,02 |
0,1447 |
0,1507 |
0,0005 |
± 0,0271 |
|
0,04 |
0,2729 |
0,0447 |
0,0002 |
± 0,0152 |
|
0,06 |
0,3994 |
0,0821 |
0,0011 |
± 0,0408 |
|
0,08 |
0,5316 |
0,0480 |
0,0006 |
± 0,0317 |
|
0,1 |
0,6917 |
0,0545 |
0,0014 |
± 0,0469 |
Регистрировали спектры 5 образцов для каждой концентрации исследуемых растворов. На всех полученных спектрах отмечены характерной формы максимумы поглощения при длине волны 275 ± 2 нм и минимумы при 255 ± 2 нм, что свидетельствует об отсутствии влияния растворителей и межмолекулярного взаимодействия на поглощение электромагнитного излучения исследуемым веществом. Спектры поглощения кислоты ацетилсалициловой в исследуемых растворах представлены на рис. 1.
Результаты статистической обработки экспериментальных данных представлены в табл. 1.
Из представленных данных следует, что компоненты системы растворителей (спирт этиловый 96 % и 0,1М раствор кислоты хлористоводородной) в различных соотношениях не оказывают значимого влияния на величину оптической плотности и последующий расчёт количественного содержания кислоты ацетилсалициловой для всех исследуемых концентраций.
Для подтверждения линейной зависимости оптической плотности от концентрации кислоты ацетилсалициловой строили градуировочный график на 5 уровнях концентраций её растворов, полученных с использованием 0,1М раствора кислоты хлористоводородной (рис. 2).
Зависимость оптической плотности от концентрации кислоты ацетилсалициловой в исследуемых растворах была аппроксимирована линейным уравнением с помощью метода наименьших квадратов. Полученное уравнение для водных растворов имеет вид:
А = 0,002 + 0,135·С,
где А – оптическая плотность (величина светопоглощения) раствора,
С – концентрация исследуемого раствора, мг/мл.
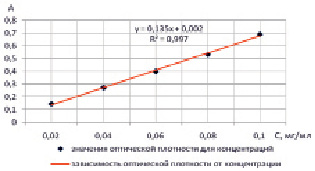
Рис. 2. График зависимости оптической плотности от концентрации кислоты ацетилсалициловой в растворе
Таблица 2
Характеристики спектрофотометрической методики
|
Определяемое вещество |
Молярная масса, г/моль |
Область линейности графика, мг/мл |
Молярный коэффициент поглощения |
Удельный коэффициент поглощения |
Определяемый минимум, мг/мл |
|
Кислота ацетилсалициловая |
180,15 |
0,02 – 0,1 |
1235,18 |
73,953 |
0,00135 |
Во всём интервале концентраций наблюдалась линейная зависимость оптической плотности от концентрации раствора, что свидетельствует о выполнении закона Бугера-Ламберта-Бера. Критерием приемлемости линейности явился и коэффициент корреляции (R2), его расчетная величина близка к единице (0,997). Таким образом, в данных интервалах концентраций методика обеспечивает определение кислоты ацетилсалициловой с требуемой линейностью.
Используя результаты построения градуировочного графика, рассчитывали молярный показатель поглощения, удельный показатель поглощения и чувствительность определения кислоты ацетилсалициловой, приняв за Аmin = 0,01. Результаты расчётов представлены в табл. 2.
Установлено, что разработанная методика достаточно чувствительна для определения биодоступности кислоты ацетилсалициловой в диапазоне концентраций при выполнении теста на растворение для исследуемых твёрдых лекарственных форм (0,05 мг/мл при среднем содержании 50 мг/табл и объёме 0,1М раствора кислоты хлористоводородной 1000 мл).
Также показано, что предел обнаружения кислоты ацетилсалициловой составляет 0,00135 мг/мл, поэтому данная методика может быть применима и для исследований биоэквивалентности in vivo для фармакокинетических концентраций в биологических жидкостях человека при употреблении в дозе 300-325 мг/сут (0,004-0,005 мг/мл, при средней массе тела 75 кг и объёме распределения 0,2 л/кг).
Нами проводились предварительные исследования устойчивости исследуемых растворов кислоты ацетилсалициловой, полученных с использованием 0,1М раствора кислоты хлористоводородной, к гидролизу или другим изменениям. Для этого спектрофотометрировали образцы в тех же условиях через 30 мин после приготовления. Установлено, что значимых расхождений в положении максимумов и минимумов, а также в значении оптической плотности не выявлено.
Для оценки точности разработанной методики проводили определение 10 аликвот модельных растворов I и II, вычисляли стандартное отклонение и относительное стандартное отклонение. На всех полученных спектрах отмечены характерной формы максимумы и минимумы поглощения, совпадающие с таковыми у исследуемых растворов. Результаты определения концентрации модельных растворов по калибровочному графику представлены в табл. 3.
Таблица 3
Анализ точности методики определения кислоты ацетилсалициловой (КАС) в модельных растворах при помощи калибровочного графика
|
Модельный раствор |
Расчётная концентрация КАС, мг/мл |
Оптическая плотность, средн. |
Найденная концентрация КАС, мг/мл |
Открываемость R, % |
Метрологические характеристики |
|
I |
0,0126 |
0,0912 |
0,0128 |
92,3 |
Rср. = 97,4 % S = 3,2691 Sr = 0,0336 |
|
0,0251 |
0,1473 |
0,0224 |
97,9 |
||
|
0,0377 |
0,2123 |
0,0312 |
99,3 |
||
|
0,0502 |
0,3219 |
0,0471 |
97,2 |
||
|
0,0628 |
0,4248 |
0,0638 |
101,9 |
||
|
II |
0,0134 |
0,0963 |
0,0152 |
93,8 |
|
|
0,0268 |
0,1734 |
0,0240 |
94,7 |
||
|
0,0402 |
0,2241 |
0,0378 |
98,6 |
||
|
0,0536 |
0,3508 |
0,0591 |
95,9 |
||
|
0,0670 |
0,4284 |
0,0644 |
102,1 |
Из представленных данных следует, что разработанная нами методика отвечает критериям точности, средняя открываемость составила 97,4 %, относительное стандартное отклонение составило 0,0336 (3,36 %), что позволяет использовать данную методику при количественном определении кислоты ацетилсалициловой в выбранных условиях.
Выводы
1. Разработана методика спектрофотометрического определения кислоты ацетилсалициловой в растворе, полученном с использованием в качестве растворителя 0,1М раствора кислоты хлористоводородной.
2. Показано, что спектр поглощения кислоты ацетилсалициловой в выбранных условиях имеет максимум поглощения при длине волны 275 ± 2 нм и минимум при 255 ± 2 нм.
3. Предложенная методика линейна в диапазоне концентраций 0,02 – 0,1 мг/мл, предел обнаружения составил 0,00135 мг/мл.
4. Данная методика применима для определения биодоступности кислоты ацетилсалициловой при выполнении теста на растворение для твёрдых лекарственных форм (предполагаемая средняя концентрация 0,05 мг/мл). Также данная методика может быть применима и для исследований биоэквивалентности in vivo для фармакокинетических концентраций в биологических жидкостях человека при употреблении в дозе 300-325 мг/сут (0,004-0,005 мг/мл).

