Создание протоколов синтеза новых гетероциклических ансамблей заданной структуры, содержащей фармакофорные фрагменты, с различной комбинацией и сочленением гетероциклов – одна из актуальных задач современной органической и фармацевтической химии.
Одним из таких подходов являются перициклические процессы [4+2]циклоприсоединения, позволяющие синтезировать новые типы конденсированных полициклических гетеросистем.
Арилметилиденовые производные 3Нфуран-2-онов являются ценными синтетическими интермедиатами для создания практически полезных веществ, в том числе лекарственных препаратов. Данные соединения являются высоко реакционноспособными, многоцентровыми системами [1-6], что делает их интересными для изучения в реакции [4+2]-циклоприсоединения в качестве диенов. На основании данных рентгеноструктурного анализа ранее для арилметилиден-3Н-фуран-2-онов подтверждена Е-конфигурация арилметилиденового фрагмента сопряженного с лактонным, что делает возможным участие изучаемых соединений в перициклических реакциях.
Наличие экзоциклическеской С=С связи в структуре изучаемых соединений позволило ранее [7-9] изучить в ряду 3-арилметилиден-3Н-фуран-2-онов в реакции [3+2]-циклоприсоединения с илидами в присутствии ацетата серебра и триэтиламина как катализаторов, способствующих образованию азааллильного иона. В результате получены спироциклические соединения.
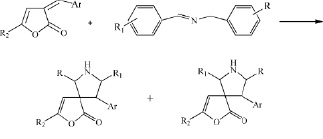
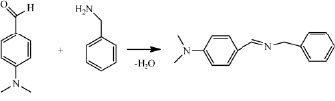
В продолжение работ изучена реакция [4+2]-циклоприсоединения в ряду арилметилиденовых производных 3Н-фуран-2-онов. В качестве азометинов использовали соединения несимметричного строения, имеющие различные заместители в ароматических фрагментах. Азометины получали перемешиванием эквимолярных количеств бензиламина и замещенных бензальдегидов в течение 1 часа, полученные кристаллы отфильтровывали и перекристаллизовывали из гексана. Физико-химические характеристики полученных азометинов совпадают с литературными данными.
Реакция 5-арил-3-арилметилиден-3Н-фуран-2-онов 1 а-с с полученными азометинами проводилась при постоянном перемешивании эквимолярных количеств реагентов в хлороформе в отсутствии катализатора при комнатной температуре в течение 7 часов.
В ИК-спектре впервые синтезированных соединений отсутствует полоса поглощения карбонильной группы, что говорит в пользу образования фурооксазиновых структур. Спектры ЯМР 1Н соединений 2 а-с содержат синглет протона третичного атома углерода в области 5.76-5.87 м.д., мультиплет протонов ароматических колец в области 6.94 – 8.31 м.д., а также синглет протонов метильной группы при 2.34-2.41 м.д. Отсутствие ряда сигналов в спектрах ЯМР 1Н, характерных для бензильного радикала позволяет предположить следующую схему реакции.
Вероятно, первоначально протекает присоединение по еноновому фрагменту арилметилиденовых производных 3Н-фуран-2-онов по типу гетерореакции Дильса-Альдера, что приводит к О-гетероциклизации, далее сопровождается элиминированием молекулы толуола и образованием устойчивых фурооксазиновых структур.
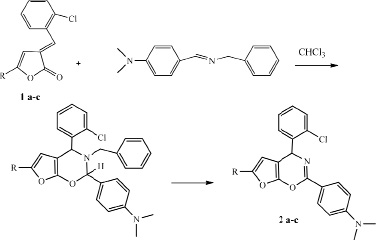
a) R = Ph, b) 4-СН3–С6Н5, c) 4-ОСН3–С6Н5
Таким образом, разработан препаративный метод синтеза 4-Ar-2-фенил-6R-4H-фуро[3,2-e][1,3]оксазинов на основе реакции 3-арилметилиден-3Н-фуран-2-онов с азометинами в условиях реакции [4+2]-циклоприсоединения.
Спектры ЯМР1Н записаны на спектрометре Varian-400, при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц. ТСХ проводили на пластинах Silufol UV-254, элюент – гексан : этлацетат : хлороформ – 2:2:1, проявитель – пары йода. Температуры плавления определены в открытом капилляре.
Элементный анализ проводили на CHNS-анализаторе Elementar модели «Vario Micro cube».
Азометины получали по нижеприведенной методике.
В плоскодонную колбу на 100 мл, снабженную обратным холодильником помещают в мольном соотношении 1:1 ароматический альдегид и бензиламин без растворителя. Перемешивают в течение 1 часа, полученные кристаллы отфильтровывают на фильтре Шотта и перекристаллизовывают из гексана.
4-Ar-2-хлорфенил-6R-4H-фуро[3,2-e][1,3]оксазины (2). В плоскодонную колбу на 100 мл, снабженную дефлегматором, помещают 0,0005 моль 3-арилметилиден-3Н-фуран-2-она, 0,0008 моль азометина в 10 мл хлороформа. Выдерживают раствор при постоянном перемешивании в течение 7 часов. Полученный раствор выливают на чашку Петри и высушивают, затем затирают из гексана. В результате получают кристаллы.
4-(4-(2-хлорфенил)-6-фенил-4H-фуро[3,2-e][1,3]оксазинn-2-ил)-N,N-диметиланилин Выход 69 %, Т.пл. 89-91 °С. ЯМР1Н, d, м.д.: 2.75 с., (6Н, СН3), 5.83 с., (1Н), 6.74 с., (1Н), 6.94-7.86 м, (13Н, аром.). Найдено %: С 73.18; Н 4.73; N 6.13. С26H21ClN2O2. Вычислено %: С 72.81; Н 4.94; N 6.53.
4-(4-(2-хлорфенил)-6-(п-толил)-4H-фуро[3,2-e][1,3]оксазинn-2-ил)-N,N-диметиланилин Выход 74 %, Т.пл. 101-103 °С. ЯМР1Н, d, м.д.: 2.34 с., (3Н, СН3), 2.90 с., (6Н, СН3), 5.75 с., (1Н), 6.68 с., (1Н), 6.45-7.56 м, (12Н, аром.). Найдено %: С 72.95; Н 4.98; N 6.64. С27H23ClN2O2. Вычислено %: С 73.21; Н 5.23; N 6.32.
4-(4-(2-хлорфенил)-6-(4-метоксифенил)-4H-фуро[3,2-e][1,3]оксазинn-2-ил)-N,N-диметиланилин Выход 78 %, Т.пл. 111-113 °С. ЯМР1Н, d, м.д.: 2.90 с., (6Н, СН3), 3.45 с., (3Н, ОСН3), 5.92 с., (1Н), 6.83 с., (1Н), 6.78-7.83 м, (12Н, аром.). Найдено %: С 71.04; Н 5.34; N 5.98. С27H23ClN2O3. Вычислено %: С 70.66; Н 5.05; N 6.10.
Работа выполнена при финансовой поддержке Российского Научного Фонда ( проект № 15-13-10007).
Библиографическая ссылка
Аниськова Т.В., Камнева И.Е., Железнова М.А., Егорова А.Ю. ГЕТЕРОРЕАКЦИЯ ДИЛЬСА-АЛЬДЕРА В РЯДУ 5-R-3-АРИЛМЕТИЛИДЕН-3Н-ФУРАН-2-ОНОВ // Международный журнал прикладных и фундаментальных исследований. 2016. № 8-5. С. 682-685;URL: https://applied-research.ru/ru/article/view?id=10149 (дата обращения: 02.01.2026).

