С появлением вычислительных методов молекулярного моделирования, позволяющих построить математические модели биологического взаимодействия, возникла необходимость в создании дополняющих, экспериментальных технологий. В то же время, развитие прецизионных методов оптической диагностики и уникальные свойства лазеров, стали основой для появления нового научно-технологического направления, получившего название биологический имаджинг. Фундаментальной задачей биоимаджинга, является, получение изображений живых биологических объектов на тканевом, клеточном и молекулярном уровнях. Характерной особенностью этих методов, является то, что они не нарушают относительное постоянство состава и свойства внутренней среды, а также процессы взаимодействия между молекулами, как на уровне целого организма, так и на субклеточном уровне [1-5].
На сегодняшний день наиболее перспективными технологиями, позволяющими наблюдать процессы на уровне молекул, являются оптические методы, среди которых особое место занимает конфокальная микроскопия. В литературе отсутствуют данные об использовании конфокальной лазерной сканирующей микроскопии для исследования взаимодействия группоспецифических антигенов с антителами. Метод визуализации антиген-антительного взаимодействия, с использование конфокальной микроскопии, имеет большой потенциал, чтобы стать в будущем стандартной технологией в научных исследованиях. Разработка данного способа оптического биоимаджинга даст возможность получить новую информацию, применимую как в фундаментальных науках о жизни, так и для развития современных лигандных технологий.
Все изложенное выше определило цель и задачи дальнейшего исследования, а именно, визуализацию специфических белок-лигандных взаимодействий с помощью лазерной сканирующей конфокальной микроскопии с использованием молекулярных зондов (естественного метаболита этанола) с последующей количественной оценкой влияния.
Материалы и методы исследования
Визуализация белок-белкового взаимодействия осуществлялась при помощи экспериментального стенда, который был реализован на базе конфокального оптического микроскопа и лазерного комбайна фирмы ANDOR (скорость сканирования до 25 слоёв в секунду). На рис. 1 приведена блок-схема установки. Стенд обеспечивал два режима микросъемки: режим конфокальной микроскопии в видимом свете и режим лазерной флуоресценции. В первом случае в качестве источника излучения использовался широкополосный источник (галогеновая лампа), а во втором – лазерные излучатели мощностью 100 мВт на длинах волн 488 нм и 561 нм.
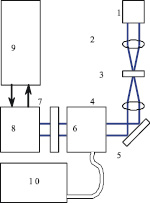
Рис. 1. Установка флуоресцентной конфокальной микроскопии: 1 – источник видимого света (галогеновая лампа), 2 – коллиматор, 3 – объект, 4 – объектив, 5 – поворотное зеркало, 6 – конфокальный сканирующий блок, 7 – блок фильтров, 8 – камера, 9 – компьютер, 10 – лазерный блок
В режиме конфокальной микроскопии свет от галогеновой лампы 1 (видимый диапазон) через блок фильтров поступает на систему фокусировки 2, которая фокусирует излучение на объекте 3. Прошедшее через объект (рассеянное вперед) излучение собирается объективом (20х или 40х) 4 и через систему зеркал и призм 5 вводится в сканирующий конфокальный блок 6. Сканирующий конфокальный блок построен по принципу Нипкова [6]: вращающиеся диски с микродиафрагмами, реализующими конфокальный метод. Перемещение фокальной плоскости (выделение анализируемого слоя ткани) осуществляется за счет управляемого с компьютера пьезоэлектрического z-микросканера, с установленном на нем объектом исследования. Спектральная фильтрация излучения осуществляется в блоке 7, реализованным в виде системы сменных фильтров, установленных на вращающейся турели. Спектральная фильтрация позволяет повысить контрастность регистрируемого изображения. После блока 7 излучение вводится в камеру 8 (1024*1024, время экспозиции 40 мс-10 мин). Для снижения темновых токов (в среднем на 3 порядка) матрица камеры захолаживается до температуры – 75 °C.
В режиме флуоресценции галогеновая лампа выключена. Вместо неё используется либо 4х модульный блок лазеров 10 (в настоящей работе использовались каналы излучения с длинами волн 488 нм и 561 нм), либо ртутная лампа. В обоих случаях используется волоконный ввод 11, а мощность каждого источника независимо управляется с компьютера (с шагом 0,1 %). Фокусировка и согласование падающего излучения осуществляется в блоке 6 при помощи вращающегося диска с микролинзами, синхронизованного с диском Нипкова.
Следует отметить, что при использовании флуоресцентной конфокальной микроскопии для контроля клеток возникает принципиальная задача обработки, распознавания и анализа слабых оптических сигналов на фоне достаточно больших шумов, вызванных тем обстоятельством, что биологическая среда является многократно рассеивающей средой. Дополнительно осуществлялась обработка шумовых пикселей полученных микроснимков. Для уменьшения шума и увеличения контрастности микроснимков использовался пороговый фильтр с порогом порядка 5 % от максимальной интенсивности кадра и заменой его на нулевой сигнал. Обработка отдельных шумовых пикселей осуществлялась в программной среде MathCad.
Объектом исследования являлась молекулярная модель АВ0 системы с последующим изучением влияния малой молекулы этанола на антиген-антительное взаимодействие. После подсчета количества эритроцитов на гематологическом анализаторе цельная кровь разводилась раствором FAX flow до примерного содержания 1х106 эритроцитов. Состав солевого раствора FAX flow: KH2PO4 – 0,02 %, Na2H PO4 – 0,21 %, NaCl – 0,8 %, KCl – 0,01 %, Na2EDTA – 0,03 %, H2O – 98,9 %. Перед постановкой реакции гемагглютинации 100 мкл эритроцитов инкубировали с 20 мкл этанола в конечной концентрации 0,03 мМ в течение 5 минут. После инкубации с биологически активными веществами проводили реакцию антиген-антитело со специфичными моноклональными конъюгированными антителами Blood group A antigen (Z2A), Blood group B antigen (89-F), меченными флуоресцеинизотиоционатом (ФИТЦ) фирмы Santa Cruz biotechnology, Inc. (США) в полистироловой пробирке в течение 20 минут в темном месте. Полученный комплекс антиген-антитело тщательно перемешивали на вортексе, к данной смеси добавляли 2 мл раствора FAX flow и проводили регистрацию изображений в модельной среде. Для анализа использовали конъюгированные маркером антитела и разведенные эритроциты, раздельно инкубированные с раствором этанола в разведении 1:5. В качестве контроля использовали разведенные эритроциты без добавления биологически активных веществ.
Результаты исследования и их обсуждение
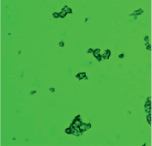
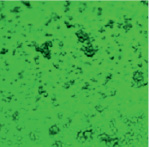
В ходе проведенного исследования нами получены электронные микрофотографии в режиме основного рассеивания, отражающие связывание моноклональных антител, меченных ФИТЦ, с антигенами А и В эритроцитов А(II) и В(III) группы крови. При взаимодействии антигенов А с антителами образуются сплошные, большие конгломераты эритроцитов, состоящие в основном, из нескольких десятков эритроцитов. Значительно реже встречаются соединения из 10 и менее эритроцитов (рис. 2, А).
А Б
Рис. 2. А – Электронная микрофотография взаимодействия эритроцитов А(II) группы крови с моноклональными антителами в режиме основного рассеивания; Б – Электронная микрофотография взаимодействия эритроцитов B(III) группы крови с моноклональными антителами в режиме основного рассеивания
По сравнению с антигеном А, антиген В образует меньше комплексов с антителом, как по количеству, так и по величине. На микроснимках эритроцитов, несущих антиген В, преобладают одиночные эритроциты, число которых кажется немного большим, чем у лиц А(II) группы крови (рис. 2, Б). Данный факт можно интерпретировать тем, что у лиц с В(III) группой крови большее количество эритроцитов в цельной крови по сравнению с генеральной совокупностью [7].
Образование большего числа комплексов эритроцитов А(II) группы крови с моноклональными антителами, принадлежащие к иммуноглобулинам класса М, может быть объяснено высокой авидностью антител, которая характеризует общую стабильность комплекса антиген-антитело, а также особенностями пространственной структуры антигена А. Как известно, авидность описывает силу кооперативных аффинных взаимодействий антиген-антитело, по-видимому, антиген А обладает большим сродством к моноклональным антителам, чем антиген В.
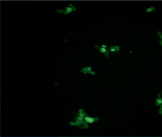
Данные конфокальной микроскопии в режиме флуоресценции показывают, что после инкубации с этанолом, количество и размер антиген-антительных комплексов, образованных антигеном А, незначительно увеличилось (рис. 3). Наблюдается объективное увеличение числа агглютинатов, образованных антигеном В В(III) группы крови (рис. 4).

А Б
Рис. 3. Микрофотографии образования комплексов антиген-антитело эритроциты A(II) группы крови в режиме флуоресценции: А – эритроциты A(II) группы крови (контрольный образец); Б – эритроциты А(II) группы крови после инкубации с этанолом
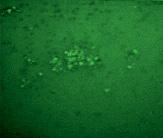
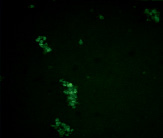
А Б
Рис. 4. Микрофотографии образования комплексов антиген-антитело эритроциты В(III) группы крови в режиме флуоресценции: А – эритроциты В(III) группы крови (контрольный образец); Б – эритроциты В(III) группы крови после инкубации с этанолом
Полученные результаты пространственного распределения интенсивности флуоресценции эритроцитов А(II) и В(III) группы крови, выявили однонаправленное действие этанола на интенсивность флуоресценции комплексов антиген – антитело (рис. 5).
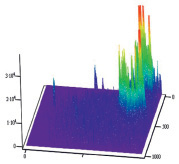
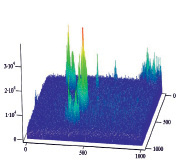
А Б
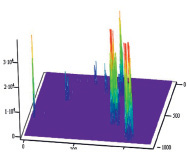
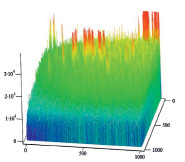
B Г
Рис. 5. Диаграммы пространственного распределения интенсивности флуоресценции в комплексах антиген – антитело: А – контрольные эритроциты A(II) группы крови; Б – эритроциты А(II) группы крови после инкубации с этанолом; В – контрольные эритроциты В(III) группы крови; Г – эритроциты В(III) группы крови после инкубации с этанолом
Диаграммы интенсивности флуоресценции комплексов антиген-антитело системы АВ0, демонстрируют небольшие изменения пиков флуоресценции для антигена А второй группы крови и значительное увеличение пиков флюоресценции для антигена В третьей группы крови, по сравнению с контрольными образцами.
Для того чтобы выяснить молекулярные особенности белок-белковых взаимодействий АВ0 системы мы оценили диаграммы размаха интенсивности флуоресценции антигенов А и В до (контроль) и после (опыт) действия этанола. После инкубации с этанолом количество антиген-антительных комплексов антигена А увеличилось незначительно, а антигена В на 15 % и составило соответственно 137,2 ± 18,3 и 182,3 ± 18,8 (рис. 6).
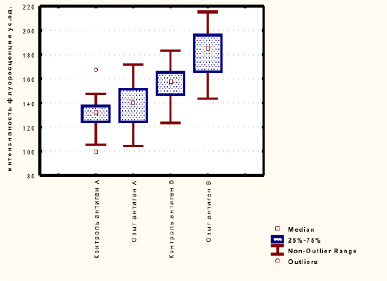
Рис. 6. Диаграммы размаха интенсивности флуоресценции антигенов А и В до (контроль) и после (опыт) действия этанола
Значения интенсивности флуоресценции в контрольных образцах антигена А было равно 130,8 ± 13,8, антигена В 155,1 ± 15,6. Полученные микрофотографии и диаграммы пространственного распределения интенсивности флуоресценции в комплексах антиген – антитело, а также количественная оценка интенсивности флуоресценции, позволяет сделать вывод, что этанол влияет на межмолекулярные взаимодействия антигенов с антителами. Серия ранее проведенных экспериментов отчетливо показала влияние лактата и других метаболитов, таких как пируват, на белок-лигандные взаимодействия антигена с антителом АВ0-системы, что является результатом суммарных модификаций, вызванных этими метаболитами [8-10].
Заключение
Таким образом, использование лазерной сканирующей конфокальной микроскопии позволило визуализировать белок-белковые комплексы и дало возможность количественно оценить характер и действие биологически активного метаболита на антигены А и В группы крови АВ0. Этанол по-разному влияет на специфические белок-лигандные взаимодействия: антиген А с терминальным N-ацетилгалактозамином показывает большую устойчивость к действию малых молекул, чем антиген В с терминальным моносахаридом D-галактозой, что подтверждает ранее проведенные эксперименты. Оптический биоимаджинг позволяет глубже и более детально взглянуть на тонкий мир специфических взаимодействий. Полученные результаты свидетельствуют о возможности использования естественных интермедиатов, в частности, лактата, молекулярного зонда и перспективности использования гликопротеинов А и В, презентированных на мембране эритроцитов, в качестве молекулярной модели для изучения и визуализации межмолекулярных взаимодействий in vitro.
Библиографическая ссылка
Колотьева Н.А., Гильмиярова Ф.Н., Тимченко П.Е., Тимченко Е.В., Рыскина Е.А. ВИЗУАЛИЗАЦИЯ АНТИГЕН-АНТИТЕЛЬНОГО ВЗАИМОДЕЙСТВИЯ С ИСПОЛЬЗОВАНИЕМ КОНФОКАЛЬНОЙ ЛАЗЕРНОЙ СКАНИРУЮЩЕЙ МИКРОСКОПИИ // Международный журнал прикладных и фундаментальных исследований. 2016. № 8-5. С. 713-718;URL: https://applied-research.ru/ru/article/view?id=10154 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.10154

