Открытия ядерной физики имеют огромное влияние на развитие почти всех отраслей человеческого деятельности [1, 2]. Исключительное значение успехи ядерной физики имеют так же и для медицины. Радионуклиды в ядерной медицине используются в виде радиофармацевтических препаратов для ранней диагностики и лечения различных патологий.
Радиофармацевтическим препаратом (РФП) называется химическое соединение, содержащее в своей молекуле определенный радиоактивный нуклид, разрешенный для введения человеку с диагностической или лечебной целью. Отличительной особенностью диагностического РФП при этом является отсутствие фармакологического эффекта [3, 4].
Ядерная медицина- раздел клинической медицины, который занимается применением радионуклидных фармацевтических препаратов в диагностике и лечении [4]. В диагностике использует главным образом однофотонные эмиссионные компьютерные томографы (ОФЭКТ/SPECT) и позитронно-эмиссионные томографы (ПЭТ-сканеры.
До недавнего времени основным диагностическим радиофармпрепаратом (далее РФП) для ПЭТ в диагностике злокачественных опухолей и в том числе опухолей головного мозга оставалась 18Фтордезоксиглюкоза (далее 18F-ФДГ). Однако недостатки 18F-ФДГ, такие как повышенное накопление этого РФП в коре ГМ и отсутствие гиперфиксации во многих опухолях мозга выдвигают необходимость использования других туморотропных радиофармпрепаратов [5].
Целью данной работы является оптимизация процессов производства и синтеза позитрон-излучающего ультракороткоживущего радионуклида в радиоизотопной диагностике с использованием метода позитронно-эмиссионной томографии для диагностики опухолей головного мозга в Казахстане.
Материалы и методы исследования
Радионуклид фтор-18 получают при облучении ядер изотопа кислород-18 пучком ускоренных протонов с энергией 15 МэВ по реакции:
18О (p,n) 18N
В качестве мишенного вещества используют воду, обогащенную по изотопу кислород-18. Образующийся радионуклид фтор-18 стабилизируется в химической форме фторида, фтор-18 ([18F],F).
Образование радионуклидов азота-13 и фтора-17.
При указанных параметрах облучения кислород-16 и кислород-17, содержащиеся в качестве примесей в облучаемом материале, претерпевают ядерные реакции с образованием радионуклидов азот-13 (период полураспада азота-13×9,96 мин), фтор-17 (период полураспада – 70 cек.), соответственно:
16О (p,α)13N
17О (p,n)17F
Химическими формами стабилизации азота-13 являются газообразный азот [13N]N2. Радионуклид фтор-17 стабилизируется в химической форме фторида, фтор-17.
Содержание азота-13 и фтора-17 в препарате на момент его изготовления теоретически не может превышать 0,01 %, что позволяет не определять радионуклидные примеси в целевом продукте.
Получение тетрабутиламмония фторида, фтор-18
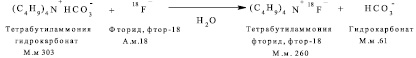
Побочная реакция. Образование тетрабутиламмония хлорида
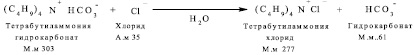
Приготовление О-(2-фторэтил)-L-Тирозин
[18F]Связывание фторида и десорбция
[18F]фторид отделяется от 18O-обогащенной воды посредством анионообменной смолы (AG 1×8, карбонатная форма) общепринятым способом (Hamacher et al., 1990). Элюирование (вымывание) активности выполняется с 0,3 мл (35 мкмоль) тетра-n-бутил гидрокарбоната аммония (pH × 8) в воде. Обезвоживание азеотропной перегонкой многократно выполняется с ацетонитрилом в стеклянном углеродистом (Sigradur®G) реакционном сосуде.
18F-фторирование
10 мг (14,8 мкмоль) O-(2-тозилоксиэтил)-N-тритил-L-тирозина третичный бутиловый эфир, растворенный в 0,5 мл сухого ацетонитрила (DNA quality), добавляется к [18F]фториду без добавления носителя и нагревается в течение 5 мин при 85 °C. Впоследствии, этот раствор выпаривается досуха с помощью потока инертного газа в течение 3 мин, поддерживая температуру в 80-85 °C.
Снятие защиты и извлечение твердой фазы
При 30 °C 1 мл смеси трифторуксусной кислоты в 1,2-дихлорэтане (1:2, v/v) добавляется и перемешивается в течение 2 мин, и затем продолжает перемешиваться в течение 7 мин при около 70 °C. После охлаждения до комнатной температуры, добавляются 5 мл дихлорметана и этот желто-зеленый раствор в течение около 2 мин проходит сквозь картридж с гелем кремниевой кислоты (силикагелем) (LiChrolut®Si60; 0,2 г). Реакционный сосуд наполняется смесью диэтиловый эфир/n-пентан (1:1) (5 мл), который используется для промывки картриджа. Этап промывки повторяется с 5 мл вышеупомянутой растворяющей смеси, и (обесцвеченный) картридж продувается (очищается) инертным газом (например, аргоном), пока реакционный сосуд нагревается при 100 °C в течение около 3 мин.
18F-меченая аминокислота, абсорбированная в силикагеле, элюируется 2 миллилитрами нагретого раствора глицината натрия (0,5 моль/л; pH 9,5), что приводит к образованию FET-содержащего раствора неочищенного (чернового) продукта (около 1,5 мл, pH 5-7), готового для применения HPLC (High performance liquid chromatography – Высокоэффективная жидкостная хроматография).
HPLC очистка
Противофазная HPLC очистка FET выполняется используя фазу C18 (с 18 атомами углерода) со встроенными полярными группами (Prontosil® 120-5-C18-ace-EPS(250×10 мм) (Bischoff Analysentechnik GmbH, Leonberg, Germany)), элюентом: этанол/вода (2/98, v/v), проток: 5 мл/мин, k' = 9,1.
Для того, чтобы обеспечить высококачественную очистку и продлить срок службы колонки, система после синтеза незамедлительно очищается (промывается) приблизительно 200 миллилитрами смеси этанол/вода (70:30, v/v). Хранение в присутствии этого растворителя гарантирует асептические условия. Перед началом синтеза колонка предварительно обрабатывается смесью этанол/вода (2/98, v/v) в течение получаса.
Технология приготовления (состав)
FET, содержащий HPLC фракцию (5-8 мл 2 % этанола), готов для введения человеку после стерилизующего фильтрования. В случае высокой концентрации активности (> 1,8 ГБк/мл), раствор следует разбавить изотоническим раствором хлорида натрия.
Контроль качества HPLC анализ
Радиохимическая чистота анализируется с помощью аналитической колонки Prontosil (250×4,6 мм) с потоком в 1 мл смеси этанол/вода (2/98). Время удержания (хроматографируемого вещества сорбентом) сравнимо с FET стандартом. Коэффициент емкости колонки: k' = 5,02.
Анализ методом газовой хроматографии (Gas chromatography, GC)
GC выполнялась на: HP 5890 Series II Precolumn: FS-Phe-Sil desact. (8 м×0,32 мм); колонка: OV 1701-DF-1.0 (50 м×0,32 мм); гелиевый поток: 12,5 мл/мин, программа температуры: с 5 °C/мин от 80 °С до 200 °C; tR (этанол): 4,16 мин; tR (диэтиловый эфир): 4,08 мин.
Энантиомерная чистота
Энантиомерная чистота незащищенной аминокислоты анализировалась с использованием HPLC-системы: Crownpak® CR(+) (150×4 мм) (Daicel Chemical Industries, Ltd.) c 20 mM хлорной кислоты; поток: 0,8 мл/мин; коэффициент емкости: k' (L-FET) = 12,5.
Сбор данных. 59-летний мужчина с рецидивирующей астроцитомой был обследован с использованием сканера ECATEXACT 951/R (CTI/Siemens, Knoxville, TN).
Пациенту перед обследованием врачом разъясняются все детали исследования, пациент дает письменное информированное согласие. Исследование начинают после внутривенной инъекции 296 МБк18F-FET на ПЭТ/КТ-сканере. После динамической эмиссионной томографии головного мозга, проводится сканирование всего тела с охватом всего тела от основания черепа до мочевого пузыря (четыре перекрывающихся положения кушетки, 5-минутное время эмиссии на каждую позицию).
Данные реконструировались методом фильтрованного проецирования на светопропускающий экран с использованием фильтра Хеннинга с частотой среза 0,8 частоты Найквиста. Количество пикселей изображения калибровались по концентрации активности (Бк/г), и нормированные значения потребления (SUVs) были вычислены с использованием формулы: SUV = концентрация ткани/введенная доза/вес тела.
Анализ данных. Для определения зон интереса (ROIs), кадры динамического интереса суммировались между 30 и 40 минутами.
Границы опухоли были определены 75 %-ми изосчётными контурами в последовательных срезах. ROIс неправильной формы размещена в контралатеральном кортикальном слое. Для определения входной функции, маленькие кольцеобразные ROI были помещены в восемь последовательных срезов в области правой сонной артерии, которая установлена в первом кадре динамического исследования. Кривые активность-время (TACs) вычислялись для опухоли, нормального головного мозга и крови. Используя эти TACs, приток L-[18F]FET в опухоль и нормальный головной мозг вычислялся путем Gоedde-Patlak анализа.
Результаты исследования и их обсуждение
Радиохимический синтез
В зависимости от концентрации тирозина, 18F-фторэтиляция приводила к выходам насыщения до 75 % ± 5 % после 6-7 мин. Эти результаты наблюдались с использованием 45 ммоль/л раствора двунатриевой соли тирозина в 300 мкл диметилсульфоксида.
Исследование пациента
Динамическое ПЭТ исследование показало быстрое и интенсивное потребление L-[18F]FET тканью опухоли головного мозга. Через 10 мин после инъекции опухоль чётко очерчивалась от нормальной ткани головного мозга (рис. 1). Концентрация (дана как SUV) L-[18F]FET, и в опухоли в нормальной коре головного мозга постоянно увеличивалась и достигла 2,0 и 0,75, соответственно, через 40 мин после инъекции (рис. 1). Из-за кинетики медленного накопления в нормальной коре головного мозга, соотношение опухоль – кора головного мозга продолжило увеличение до конца исследования и достигло значения 2,7 через 40 мин после инъекции (рис. 2). Кривая крови показала биэкспоненциальную диаграмму с конечным периодом полураспада 40 мин (рис. 1).
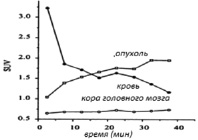
Рис. 1. Изменение со временем активности, локализованной в пуле крови (●), опухоли (□) и исходной ткани (кора головного мозга, 0) после внутривенного введения L-[18F]FETпациенту с рецидивирующей астроцитомой
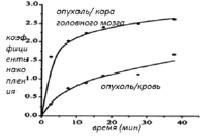
Рис. 2. Изменение со временем соотношений накопления L-[18F]FET опухоль – кровь и опухоль – кора головного мозга после внутривенного введения L-[18F]FET пациенту с рецидивирующей астроцитомой
Это привело к строго возрастающему соотношению опухоль – кровь до конца периода исследования (рис. 2).
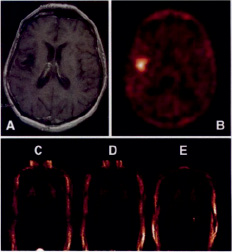
Рис. 3 Сравнительная картинка накопления L-[18F]FET (B) и T1 взвешенная MR картинка после введения Gd-DTPA(A) пациента с рецидивирующей астроцитомой. Изображение активности препарата показана между 30 и 45 мин после инъекции 296 МБк L-[18F]FET. Границы опухоли были определены 75 %-ми изосчётных контуров. Нижний ряд: регионарные изображения тела одного и того же пациента (от брюшного к спинному: C, D, E).
Сканирование всего тела, начатое через 40 мин после инъекции, показало выведение радиоактивного индикатора почками. Печень и поджелудочная железа не показали более высокого потребленияL-[18F]FET, чем активность кровяного депо. Так же не наблюдалось накопления радиоактивного индикатора в кости, костном мозгу или кишечнике.
Синтез [18F]FET был выполнен примерно за 50 мин. с общим радиохимических выходом в 40 %.Потребление L-[18F]FET в головном мозге достигало > 2 %ID/g между 30 и 60 мин. после инъекции. Потребление D-изомера мозгом было незначительным, показывающее проникновение через гематоэнцефалический барьер специфической системы транспортировки аминокислот.L-[18F]FET не включается в белки. Исследование методом жидкостной хроматографии высокого разрешения (ЖХВР) мозга, поджелудочной железы и ткани опухоли при 10, 40 и 60 мин. после инъекции показало только неизменившийся L-[18F]FET. Потребление активности в кости не превышало 2 % ID/gпри 40 мин. после инъекции. В первом исследовании человека, L-[18F]FET-PET позволило получить отчетливое очерчивание рецидивирующей астроцитомы. При 35 мин. после инъекции, соотношение опухоль-кора головного мозга было > 2,7. Соотношение опухоль-кровь >1,5 было достигнуто после 30 мин. после инъекции и продолжило увеличение. Не наблюдалось никакого значительного накопления активности в периферических органах после приблизительно 40 мин. после инъекции.
Таким образом, производство и синтез РФП- L-[18F]FET его высокая стабильность в организме, быстрая кинетика накопления в мозгу и опухоли, его малое накопление в неопухолевой ткани и его простота синтеза определяют дальнейшую оценку L-[18F]FET, как индикатора аминокислоты для опухолей головного мозга.
Поскольку скорость синтеза белка в нормальной ткани головного мозга на несколько порядков ниже, чем употребление им глюкозы (приблизительно 0,5 нмоль/г/мин для лейцина против 0,3 мкмоль/100 г/мин для глюкозы [6]), аминокислотные радиоактивные индикаторы были предложены в качестве альтернативы ФДГ в описании характера метаболизма опухолей головного мозга [7]. 2-[18F] фтортирозин и p-[18F]фторфенилаланин не нашли регулярного применения из-за их сложных и с низким выходом синтезов [8-10]. Синтез L-[18F]FET прост, эффективен и требует лишь имеющиеся в продаже химикаты и никакого сложного оборудования. Процесс 18F-фторалкиляции часто используется и является простым, начинаясь с нуклеофильного 18F-фторида [11, 12]. Весь синтез заканчивается менее чем за 1 ч, с радиохимическим выходом приблизительно 40 % на основе 18F-фторида.
В сравнении со всеми другими аминокислотами, изученными до сих пор, L-[18F]FET показывает наивысшее потребление головным мозгом в последних исследованиях. Отличные от других искусственных аминокислот, таких как IMT, которая не удерживается в головном мозгу, но демонстрирует начальный максимум потребления и быстро удаляется из организма [13], кинетики L-[18F]FET в головном мозгу показывают более долгое удерживание посредством неизвестного механизма [14, 15]. Медленное вымывание наблюдалось только по истечении 1 ч. Поскольку исследования состава гомогенатов головного мозга показали только присутствие исходного радиоактивного индикатора, дальнейшие эксперименты проводятся для объяснения удерживания данного индикатора.
Заключение
L-[18F] FET является 18F-меченой аминокислотой для радионуклидной диагностики опухолей головного мозга. Высокая стабильность внутри организма, быстрое накопление в головном мозгу и опухоли, низкое накопление в неопухолевой ткани и простота синтеза определяют дальнейшее применение L-[18F]FET в качестве аминокислотного радиоактивного индикатора опухоли.
В отличие от [11C]метионина, L-[18F]FET не накапливался в костном мозгу, почке или поджелудочной железе и, таким образом, может иметь применение в обнаружении периферических опухолей. L-[18F]FET может найти широко распространенное применение, так как может быть произведен с большим выходом активности препарата.
Известными производителями радиофармпрепаратов остаются США, Япония, Германия и ряд других стран. В этом направлении нами ведется тесное сотрудничество с учеными Университета Charite и Клиники Vivantes, производственной базой ядерной медицины (г. Берлин, г. Юлих, Германия).
Оптимизация процессов производства и синтеза современных радиофарпрепаратов в Казахстане, в том числе 18F-FET положат начало созданию целого класса новых препаратов, меченных ультра-короткоживущими позитрон-излучающими радионуклидами.
Широкое внедрение ПЭТ/КТ с использованием новых РФП в клиническую практику Казахстана для выявления опухолей головного мозга, помимо влияния на диагностический процесс имеет важную экономическую составляющую. Это объясняется тем, что благодаря повышению эффективности диагностики, выявлению заболеваний на более ранних стадиях их развития и своевременному назначению адекватного лечения удается существенно сократить расходы на лечение, уменьшить продолжительность стационарного и амбулаторного лечения, улучшить прогноз, уменьшить инвалидизацию и сократить смертность. Полноценная диагностика, совмещающая в себе компьютерную и позитронно-эмиссионную томографию, заметно снижает необходимость повторного лечения.
Библиографическая ссылка
Прмантаева Б.А., Рыскулов А.Е., Рыскулова Г.О., Байдуллаева Г.Е. ОПТИМИЗАЦИЯ ПРОИЗВОДСТВА И СИНТЕЗА РАДИОФАРМПРЕПАРАТА 18F-FET В КАЗАХСТАНЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА // Международный журнал прикладных и фундаментальных исследований. 2016. № 9-1. С. 78-83;URL: https://applied-research.ru/ru/article/view?id=10195 (дата обращения: 03.02.2026).

