Гетерогенная система гемоглобина является классической системой изо-протеинов, исследование которых ведется уже около века. Однако, эмбриональный гемоглобин (HbP), являющийся одним из канонических стадиоспецифических типов гемоглобина человека, является, пожалуй, одним из самых малоизученных изотипов системы гемоглобина. Крайне скудны сведения о динамике его синтеза в процессе онтогенеза, физико-химических свойствах, клинико-диагностическом значении, а данные о методах оптимального выделения HbP в доступной литературе просто не отражены. Существует, на наш взгляд, две причины такого парадоксального низкого интереса к этому хромопротеину: во-первых, продукция эмбрионального гемоглобина полностью репрессирована у детей и взрослых, что делает этот белок непривлекательным для клиницистов, в плане его прогностическо-диагностической ценности; во-вторых, выделение и очистка HbP (с целью дальнейшего его изучения) очень затруднительна из-за его низкой концентрации в эмбриональных тканях и сложностей забора биоматериала [3, 5, 6, 7].
HbP имеет тетрамерное строение, молекулярная масса – около 65000 Да. По физико-химическим свойствам он сходен с фетальным гемоглобином: они оба имеют более высокое, чем гемоглобин взрослого, сродство к кислороду, сходные электрофоретическую подвижность, щелочную резистентность, коэффициент седиментации (4,5 S) и спектр поглощения. Синтез этого протеина, по разным данным, осуществляется в желточном мешке и печени эмбриона в период с 4 по 12 неделю гестации [2, 4, 7, 9].
Немногочисленные работы последних лет опровергают устоявшееся мнение о HbP, как протеине с нулевой прикладной значимостью и свидетельствуют о его значении, как канцероэмбрионального антигена при миелопролиферативных заболеваниях крови [1, 8].
В свете вышесказанного, актуальной задачей является разработка оригинального алгоритма поучения чистого препарата эмбрионального гемоглобина, с целью его дальнейшего фундаментального изучения.
Цель исследования: разработка оптимального способа выделения и очистки эмбрионального гемоглобина человека.
Материалы и методы исследования
Исходным материалом для фракционирования белка служил абортивный материал сроком 5-11 недель, который получали только с письменного согласия пациенток, в ходе плановых абортов, без сопутствующей патологии, проводимым с целью прерывания незапланированной беременности. Всего получено 387 г абортивного материала от 49 пациенток с беременностью вышеуказанных сроков.
Сортировку абортивного материала (отделение эмбриональных тканей от материнских и оболочечных тканей) осуществляли при участии квалифицированных гистологов.
Гомогенизацию эмбриональных тканей проводили механически-термическим способом. Экстрагирование цитозольных белков проводили добавлением 0,85 % раствора хлорида натрия в объемном соотношении 1:1. Для удаления клеточных элементов взвесь центрифугировали при 5000 об/мин в течение 25 мин, после чего осадок отбрасывали.
В работе использовали методы комбинированной щелочной денатурации (поэтапная обработка гемолизата раствором сульфата аммония 50 % насыщенности и 1,2 М раствором едкого натра с последующей седиментацией при 8000 об/мин), путем гель-фильтрацию на sephadex G-10 и ионообменную хроматографию на ДЕАЕ-sephadex А-50 и на QAE-sephadex A-50.
Эффективность выделения HbP оценивали по стандартным характеристикам очистки: абсолютным количествам искомого белка в препарате, относительной массовой доле искомого белка, степени очистки и выходу продукта.
Для математического анализа результатов исследования был использован лицензионный пакет прикладных программ статистического анализа Excel-2010 (Microsoft) и Statistica 6.0 (StatSoft. Inc.),. Для каждой выборки результатов очистки вычисляли средние величины (М) и среднюю ошибки средней арифметической (m). С целью определения значимости степени разброса применялся однофакторный дисперсионный анализ с вычислением критерия F Фишера.
Результаты исследования и их обсуждение
В ходе работы разработан оригинальный алгоритм выделения и очистки эмбрионального гемоглобина, включающий последовательные этапы:
1. Гомогенизация и экстрагирование биоматериала. После двукратного замораживания (при – 18 °С) и оттаивания эмбриональная ткань измельчалась и подвергалась механической гомогенизации с использованием в качестве абразива мелкодисперсной стеклянной крошки.
Экстрагирование цитозольных белков проводили добавлением 0,85 % NaCl в объемном соотношении ткань-раствор: 1 к 1. После центрифугирования при 5000 об/мин в течении 25 мин осадок отбрасывали.
2. Щелочное осаждение. Предлагаемая щелочная денатурация позволяет быстро и эффективно избавиться от большинства примесных белковых компонентов, лабильных к воздействию щелочей.
В 2 мл раствора, содержащего HbP, добавляли 0,2 мл 1,2 М раствора NaOH, и через 40 секунд добавляли 2 мл насыщенного раствора сульфата аммония (до 50 %-й насыщенности). При этих условиях щелочелабильные внутриэритроцитарные белки денатурируют и седиментируют. После центрифугирования при 8000 об/мин в течение 25 мин осадок отделяли. Полученный белковый препарат подвергали обессоливанию путем гель-фильтрации на колонке с сефадексом G-10, рабочий буфер – 0,05 М фосфатный буферный раствор рН 7,4.
3. Ионообменная хроматография на ДЕАЕ-sephadex А-50. Тонкую очистку проводили путем ионообменной хроматографии на ДЕАЕ-sephadex А-50. В качестве рабочего буфера использовали 0,01 М трис-хлоридный буфер рН 8,1.
Анализ качества выделения HbP
|
Основные этапы выделения |
Общий белок, мг/л |
Кол-во продукта, мг|л |
Целевой продукт, % |
Степень очистки HbP |
|
Экстракт эмбриональных тканей |
859 |
32 |
3,73 |
1 |
|
Щелочное осаждение |
112 ± 4,4 |
24 ± 2,1 |
21,43 ± 1,9 |
5,75 ± 0,6 |
|
Ионообменная хроматография на ДЕАЕ-sephadex А-50 |
17 ± 1,0 |
5,5 ± 0,6 |
32,35 ± 2,8 |
8,67 ± 0,9 |
|
Ионообменная хроматография на QAE-sephadex A-50 |
1098 ± 63,2 |
977 ± 52,9 |
88,98 ± 4,3 |
23,86 ±1,8 |
Примечание. Суммарный коэффициент дисперсии F = 5,6.
Полученный на предыдущем этапе полуочищенный препарат предварительно забуферивали диализом в течение ночи против 3 л 0,01 М трис-хлоридного буфера рН 8,1. Затем 15-20 мл адаптированного препарата вносили в колонку, проводили 30-минутную остановку-экспозицию для фиксации HbP на катионных группировках геля и начинали процесс хроматографии. Элюцию проводили в градиенте ионной силы с повышением осмолярности буферного раствора путем ступенчатого добавления хлорида натрия.
4. Ионообменная хроматография на QAE-sephadex A-50 – ключевой этап, позволяющий не только очищать, но и значительно концентрировать HbP, полученный на предыдущем этапе.
Главной проблемой при очистке HbP, после третьего этапа, было крайнее разведение белка до очень низких концентраций. QAE-sephadex был выбран в качестве сорбента в силу его чрезвычайно высокой емкости, что позволяет не только очищать, но и концентрировать препарат в десятки раз. В качестве рабочего буфера был выбран 0,05М трис-НCl буфер, рН 6,5.
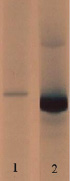
Рис. Анализ чистоты полученного препарата HbР методом электрофореза в ПААГ. 1 – Очищенный препарат HbP; 2 – гемолизат крови взрослого человека
Материал, предназначенный для хроматографии предварительно доводили до рН 6,5 путем диализа против рабочего буфера в течении 3 часов.
Белковый раствор вносили в колонку из расчета: 15 мл раствора на 1 мл геля. Элюцию фиксированного на геле белка проводили резким однократным подъемом ионной силы буфера до 0,5 Моль/л (добавлением NaCl). В таких условиях весь фиксированный на геле белок быстро элюировался в малом объеме (эффект концентрирования).
Контроль качества очистки проверяли электрофорезом полученных белковых препаратов в полиакриламидном геле (рисунок).
Эффективность разработанного способа получения эмбрионального гемоглобина оценивали по основным характеристикам очистки: абсолютным количествам искомого белка в препарате, относительной массовой доле искомого белка, выходу целевого продукта и степени очистки (таблица).
Заключение
Разработанный способ выделения и очистки эмбрионального гемоглобина имеет следующие преимущества:
1. Скорость – все этапы процесса занимают не более суток;
2. Получение препарата HbP высокой степени очистки;
3. Многократность использования ионообменного сорбента позволяет применение поточного подхода;
4. Концентрирование материала – заключительный этап реализует сразу две задачи: тонкая очистка белка и параллельное эффективное его концентрирование в 150-200 раз (!).
Библиографическая ссылка
Кривенцев Ю.А., Доценко Ю.И., Гудинская Н.И., Кривенцева М.Ю. НОВЫЙ СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ЭМБРИОНАЛЬНОГО ГЕМОГЛОБИНА ЧЕЛОВЕКА // Международный журнал прикладных и фундаментальных исследований. 2016. № 11-2. С. 243-245;URL: https://applied-research.ru/ru/article/view?id=10473 (дата обращения: 03.03.2026).

