В настоящее время в ортопедии и травматологии все чаще приходится решать вопрос о замещении дефектов костной ткани как органическими, так и неорганическими материалами. С увеличением оперативных вмешательств, в связи с эндопротезированием крупных суставов, растет и количество ревизионных хирургических вмешательств, связанных как с инфекцией области оперативного вмешательства (ИОХВ), так и с нестабильностью компонентов эндопротеза. Очень часто после таких операций встает вопрос о замещении костного дефекта с целью дальнейшего реэндопротезирования. Возможно несколько вариантов костной пластики, и первоочередным является выбор материала – будет ли это органический, неорганический, либо комбинированный материал – зависит от размера дефекта, состояния костной ткани, степени остеопороза, сопутствующий хронической патологии и ряда индивидуальных особенностей конкретного пациента. Однако, не смотря на выбор материала в клинических случаях связанных с необходимостью замещения существенных объемов костного дефекта целесообразно использовать метод индивидуальной костной пластики с использованием объемной 3Д-печати, фактически речь идет о создании индивидуального имплантата наиболее точно, с точки зрения анатомии, замещающего костный дефект.
Цель исследования – сформулировать основные требования к современным синтетическим материалам, используемым для создания индивидуальных имплантатов методом объемной 3Д-печати. Детально рассмотреть свойства нейлона 618 в сравнении с другими синтетическими материалами.
Определимся с основными терминами, которые в дальнейшем будут использованы в работе. Индивидуальный имплантат представляет собой трехмерную пористую или волокнистую матрицу, основная функция которой состоит в обеспечении механического каркаса для клеточной культуры [1]. Биоинертность – способность материала в течение длительного времени сохранять постоянство своего состава и структуры благодаря отсутствию локального и системного взаимодействия с организмом либо его минимально выраженному химическому, электрохимическому и поверхностно-каталитическому проявлению. К биоинертным материалам относятся металлы, их сплавы, полимеры, корундовая керамика, углерод [2–5]. Биоактивные материалы являются матрицей для образования костной ткани на их поверхности, то есть обладают остеогенными свойствами (остеокондуктивными и (или) остеоиндуктивными), таким образом, биоактивность характеризует способность материала к биодеградации [2–6]. Остеоиндукция – это способность материала трансформировать недифференцированные мезенхимальные клетки в остеобласты. Остеокондукция – это свойство материала служить каркасом для вновь образующейся костной ткани [2, 3].
Исходя из своего предназначения, индивидуальный имплантат созданный методом контурной пластики должен обладать рядом свойств, позволяющих достигнуть формирования полноценной костной ткани, либо надежной опороспособности биоинертным материалом. Такими свойствами являются: наличие адгезивной поверхности, способствующей пролиферации и дифференцировке клеток; биосовместимость и отсутствие иммунологического отторжения; атоксичность; биодеградация, скорость которой соответствовала бы росту собственной ткани; оптимальный размер пор для васкуляризации, а также диффузии питательных веществ и удаления продуктов жизнедеятельности [7]. Фактически имплантат выполняет функции, аналогичные функциям внеклеточного матрикса, основополагающим фактором при выборе материала является его способность к частичной имитации внеклеточного матрикса [1]. В целом можно выделить три основные группы материалов, применяемых при изготовлении индивидуальных имплантатов: природные полимеры, синтетические полимеры, биокерамика и комбинированные материалы. Природные полимеры и биокерамические материалы подробно рассмотрены И.А. Кириловой с соавт. [2]. Мы подробно остановимся на синтетических материалах, так как анализ свойств натуральных полимеров показал, что одним из объединяющих их недостатков является малая механическая прочность. Если учитывать факт, что каркасная функция – это главная функция имплантата, то данный недостаток представляется существенной проблемой при регенерации костной ткани, поскольку часто основная задача ортопедии и травматологии – восстановление опороспособности конечности [1].
Причины растущего интереса со стороны ученых к синтетическим материалам для тканевой инженерии заключается в следующем: простота их изготовления и химической модификации, хорошая биосовместимость, высокая универсальность, подходящие механические свойства и контролируемая способность к остеоиндукции. Возможность использовать синтетические материалы в 3D-печати также один из важнейших плюсов. Наиболее популярны полимолочная, полигликолевая кислоты и их сополимеры.
Синтетические полимеры, как правило, делят на две группы: биодеградируемые и небиодеградируемые. Биодеградируемые материалы включают полилактид, полигликолид, их сополимер полилактогликолид, поликапролактон, полицианоакрилат и др. В группу небиодеградируемых полимеров входят поливиниловый спирт, поли-гидроксиэтилметакрилат, поли-N-изопропилакриламид и др. [6].
Полилактид – биодеградируемый, термопластичный, алифатический полиэфир, который может быть получен путем поликонденсации молочной кислоты и полимеризации лактида – димера молочной кислоты. В производстве обычно используют комбинацию этих методов. Лактид обладает оптической активностью и может существовать в виде стереоизомеров L-лактида, D-лактида и рацемических форм LD-лактида. Соответственно, в зависимости от того, из какой формы состоит полилактид, меняются его характеристики. L- и D-лактиды имеют высокую степень кристалличности и схожие физико-химические свойства, LD-лактид представляет собой аморфный материал. Полученный из L-лактида полимер имеет очень низкую скорость биодеградации (полное разложение может происходить в течение нескольких лет). Полилактид из LD-лактида как аморфный материал имеет, напротив, высокую скорость биодеградации, но его механические свойства достаточно низкие. Сополимеры L-лактида и LD-лактида придают полилактиду механическую прочность и приемлемую скорость деградации. Еще одним плюсом полилактида является его хорошая биосовместимость [6].
Недостаток данного полимера заключается в плохой смачиваемости и, соответственно, неравномерном распределении клеток. Продуктами его распада являются СО2 и вода, что приводит к локальному закислению. Не исключены воспалительные реакции при введении полилактида в организм. Также этот материал показывает недостаточную прочность при сжатии.
Полигликолид – это самый простой линейный алифатический полиэфир, представляющий собой полимер гликолевой кислоты. От полилактида он отличается высокой степенью кристалличности из-за отсутствия в структуре боковых метильных групп и низкой скоростью деградации. В регенерации костных тканей обычно используют сополимер полилактида и полигликолида – полилактогликолид. Данный сополимер является довольно привлекательным материалом для тканевой инженерии по причине хорошей биосовместимости, возможности модулирования скорости биодеградации. К тому же под воздействием подсаженных клеток полилактогликолид разлагается на мономеры – природные метаболиты, такие как молочная и гликолевая кислоты, хотя это может вызывать и негативные последствия в связи с нежелательным закислением [8].
В целом использование различных комбинаций стереоизомеров полилактида, сополимеризации полилактида и полигликолида направлено на регуляцию скорости биодеградации скаффолдов [8].
Поликапролактон – это биодеградируемый, полукристаллический, алифатический полиэфир. В качестве его мономера выступает капролактон [9]. Данный материал обладает хорошими механическими свойствами, биосовместимостью, а также довольно легок в обработке. Однако из-за внутренней гидрофобной структуры и отсутствия биоактивных функциональных групп поликапролактон представляет собой не очень благоприятную среду для роста клеток, что ограничивает применение этого полимера в тканевой инженерии [9]. На данный момент многие методики направлены на модификацию поверхности поликапролактона адгезивными материалами [9].
Поливиниловый спирт – материал из группы небиодеградируемых синтетических полимеров, он представляет собой термопластичный полимер, получаемый путем гидролиза сложных поливиниловых эфиров [6]. Поливиниловый спирт – механически стабильный и гибкий материал, растворяющийся в воде при достаточно высоких температурах – порядка 70°С [6]. В список его достоинств можно также включить высокую степень гидрофильности и полупроницаемость для кислорода и питательных веществ. Несмотря на прекрасные механические качества, отсутствие биодеградации, как и у всех материалов этой группы, является серьезным ограничением в использовании данного полимера [6].
Нейлон (nylon) – семейство синтетических полиамидов, привлекателен своей высокой износоустойчивостью и низким коэффициентом трения. Так, нейлон зачастую используется для покрытия трущихся деталей, что повышает их эксплуатационные качества и зачастую позволяет функционировать без смазывающих жидкостей. Вслед за широким применением нейлона в промышленности, материалом заинтересовались и в сфере аддитивного производства. Попытки печатать нейлоном предпринимались практически с первых дней технологии FDM/FFF. Нейлон устойчив к спиртам, смолам, щелочам, кислотам и ацетону.
К недостаткам нейлона можно отнести слишком высокую температуру плавления, сильную гигроскопичность (нить натягивает влагу) и определенную токсичность при расплаве. Сейчас известным американским производителем материалов для 3D принтеров Taulman начата продажа нового модифицированного nylon 618, отличающегося повышенной прочностью (от 80 до 2800 МПа, модуль Юнга 7,4 ГПА), а также отсутствием в его составе тяжелых металлов и токсичных соединений [10].
Поскольку при замещении дефектов костной ткани одним из основных требований к материалу трехмерного носителя является его высокая механическая износостойкость, способная противостоять нагрузкам, возникающим в скелете при движении, то в этом случае именно nylon 618 наиболее близок к механическим параметрам компактной костной ткани (прочность на сжатие/растяжение до 170 МПа, модуль Юнга 10 ГПа) [10].
Основные механические характеристики материалов приведены в таблице.
Стоит отметить, что все вышеперечисленные полимеры возможно использовать в качестве расходного материала при 3D-печати для создания индивидуальных имплантатов. Данная технология подразумевает несколько этапов. На первом этапе проводится МСКТ (толщина слоя 0,5 мм, лучевая нагрузка 2,0±0,9 мЗв). Полученные данные в виде серии DICOM-файлов с использованием специализированного программного обеспечения конвертируются в 3D-модель дефекта в формате obj. Данный формат совместим с программами 3D-моделирования (Autodesk 3D Studio Max, Autodesk Maya и др.). Второй этап состоит в моделировании и объемном скульптинге области костного дефекта, то есть фактически в виртуальном создании имплантата, и «примерки» его на область дефекта. Стандартными средствами программного обеспечения выполняем зеркальное отображение здоровой стороны на поврежденную область, заполняем объем дефекта объемом имплантата и за счет вычитания из большего объема (зеркальная копия здоровой стороны) меньшего объема (область деформации) получается прототип имплантата. Далее проводится адаптация мест прилегания модели имплантата к области деформации и, при необходимости, модификация его формы и прилегания (виртуальная скульптура). Затем следует третий, завершающий этап – модель сохраняется в формате stl, необходимом для CAD/CAM-производства, файл имплантата изготавливается на 3D-принтере.
Учитывая выше сказанное, считаем целесообразным использовать нейлон 618 в качестве расходного материала в случаях индивидуальной контурной пластики костных дефектов объемными носителями.
Пример индивидуальной пластики приведен на рисунке.
Сравнительные характеристики механических показателей рассматриваемых синтетических материалов
|
Материал |
Прочность на растяжение (МPa) |
Модуль Юнга (GPa) |
|
Полилактид |
29–150 |
1,9 |
|
Полигликолид |
350–920 |
12,5 |
|
Поликапролактон |
23 |
0,4 |
|
Поливиниловый спирт |
12–17 |
1,1 |
|
Нейлон 618 |
70–2800 |
7,4 |
|
Костная ткань |
100 |
10 |
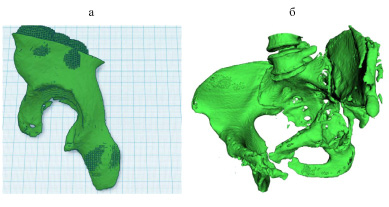
Контурная пластика на примере костного дефекта костей таза слева: а – индивидуальный имплантат смоделированный простой инверсией здоровой стороны костей таза; b – 3D-модель костей таза с дефектом построенная по МСКТ
Заключение
Несмотря на развитие технологий производства имплантатов и расширение возможностей лабораторного синтеза клеточной культуры, все же наиболее часто и эффективно в ортопедии и травматологии применяют аутогенную остеопластику. Однако это не всегда возможно при выраженном остеопорозе и при необходимости замещения обширного дефекта костной ткани. Именно в этих случаях стоит рассматривать использование индивидуального имплантата и выбор материала для его формирования. В дальнейшем планируется проведение ряда экспериментов на базе Новосибирского НИИТО с нейлоном 618, с целью детального определения его свойств, динамики поведения in vitro в различных средах и решении о возможности использования данного материала в эксперименте in vivo. В итоге это может привести к созданию новых тканеинженерных решений, позволяющих с успехом решать проблему устранения обширных костных дефектов методом индивидуальной контурной пластики объемными имплантатами.
Библиографическая ссылка
Мамуладзе Т.З., Базлов В.А., Павлов В.В., Садовой М.А. ИСПОЛЬЗОВАНИЕ СОВРЕМЕННЫХ СИНТЕТИЧЕСКИХ МАТЕРИАЛОВ ПРИ ЗАМЕЩЕНИИ КОСТНЫХ ДЕФЕКТОВ МЕТОДОМ ИНДИВИДУАЛЬНОЙ КОНТУРНОЙ ПЛАСТИКИ // Международный журнал прикладных и фундаментальных исследований. 2016. № 11-3. С. 451-455;URL: https://applied-research.ru/ru/article/view?id=10516 (дата обращения: 08.02.2026).

